Room 810, 8F, No. 780, Cailun Road, Pudong New Area, Shanghai, China.
新闻动态
文献分享 | 基于BMSCs的梯度微环境模拟软骨类器官在骨软骨修复中的研究进展
骨软骨缺损(OCD)通常由创伤或骨关节炎引起,表现为关节软骨和软骨下骨的损伤并呈进行性发展。膝关节的天然骨软骨结构由三层组成:关节软骨、钙化软骨和软骨下骨,它们以梯度异质性无缝过渡。关节软骨主要由II型胶原蛋白和蛋白聚糖组成,无血管并且依赖滑液提供氧气和营养。软骨下骨是高度血管化的硬组织,提供结构支撑和刚度。钙化软骨层作为过渡结构。这三种成分共同形成梯度异质性骨软骨组织,软骨的无血管性质限制了其内在的自我修复能力,这种梯度异质性使得仿生修复成为了OCD再生和修复的重大挑战。
尽管临床上存在多种OCD治疗方法,例如关节镜清创术、微骨折术、干细胞移植以及自体/同种异体移植,但目前尚无任何方法能够实现梯度异质性的软骨和软骨下骨的整合再生,移植失败仍然是一个重大问题。近日海南省人民医院乳腺外科陈茹团队与同济大学附属上海市肺科医院的研究团队合作在Journal of Nanobiotechnology (IF=10.6)发表了题为《Single BMSC‑derived cartilage organoids for gradient heterogeneous osteochondral regeneration by leveraging native vascular microenvironment》的研究成功。作者利用骨髓间充质干细胞(BMSCs)在体外构建软骨类器官,通过模拟从无血管的关节软骨到高度血管化的软骨下骨的梯度微环境,成功制备出具有梯度异质性的仿生结构。该方法首次实现了软骨-钙化软骨-软骨下骨的三层结构仿生构建,为骨软骨缺损(OCD)的临床修复提供了新的治疗思路和技术指导。以下我们为您带来该研究成果的详细解读:

Journal of Nanobiotechnology,29 April 2025
doi:10. 1186/ s12951- 025- 03403-0
原文链接:https://jnanobiotechnology.biomedcentral.com/articles/10.1186/s12951-025-03403-0#article-info
研究内容解读
一、兔骨髓间充质干细胞的分离、鉴定及分化评价
研究人员首先从兔骨髓中分离骨髓间充质干细胞(BMSC)并进行了鉴定。P0代骨髓间充质干细胞主要表现为三角形、纺锤形或梭形形态,至第三代为止具有均匀的细胞骨架形态。后续通过流式细胞术对表面标志物的分析以及茜红素(成骨)和阿利新蓝(成软骨)染色,确定P3代BMSCs为最佳种子细胞,平衡纯度与分化能力,为后续类器官构建奠定基础(图1)。
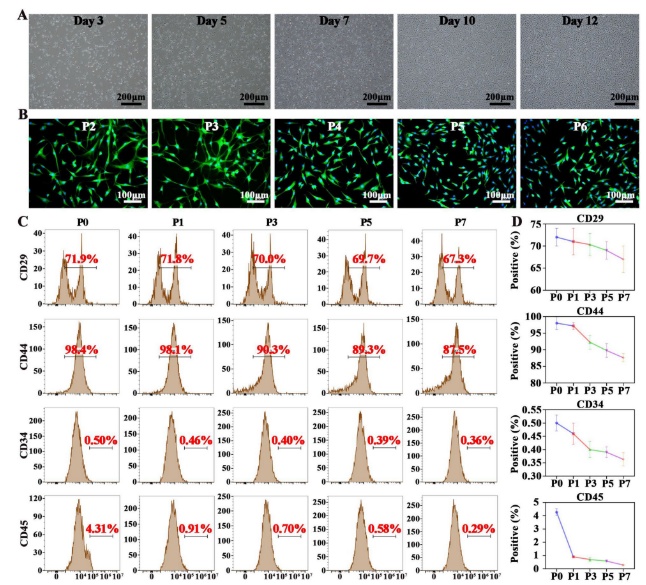
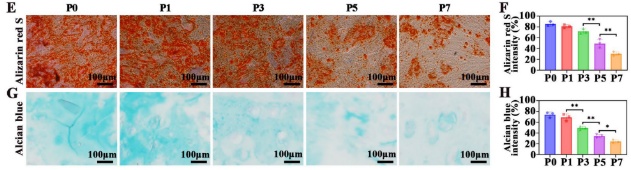
图1 髓间充质干细胞的分离和鉴定
二、使用BMSCs构建软骨类器官
为了构建软骨类器官,研究人员使用光刻模具制备了含有超过2000个微腔的琼脂糖支架,实现BMSCs单细胞球高效组装(500个细胞/微腔)。在3D培养条件下,BMSC于第2天自聚集成球(直径23μm),第28天时表现为成熟软骨类器官,直径可达190 μm。H&E染色结果显示该模型能模拟软骨基质,高表达胶原酶II (COL II)与蛋白聚糖Aggrecan(图2)。
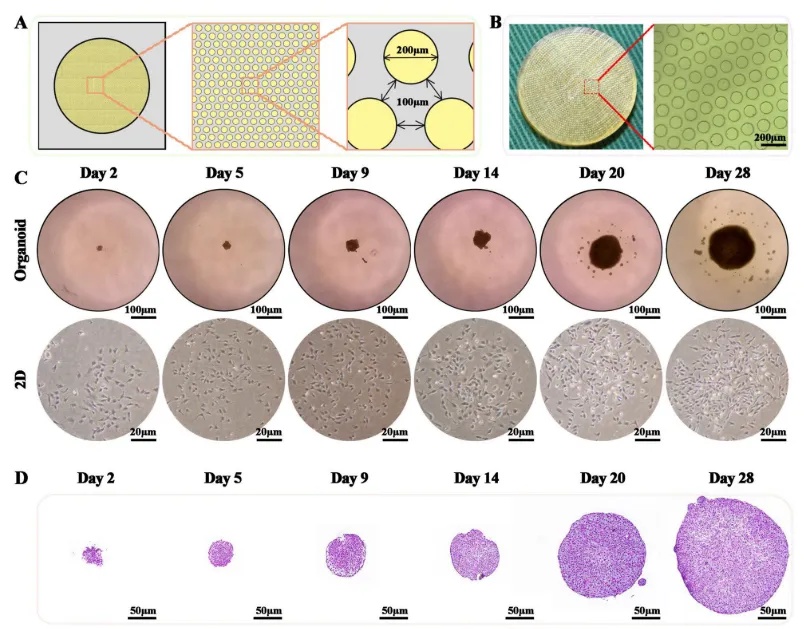
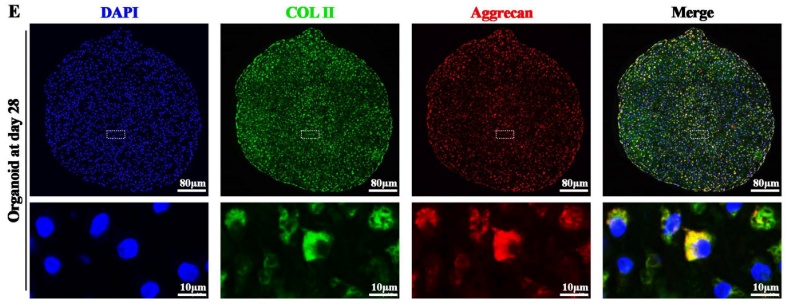
图2 高密度琼脂糖平台开发软骨类器官
三、软骨类器官在无血管与血管微环境中的体外分化评价
为了评估血管微环境如何调节软骨类器官分化,研究人员在体外软骨类器官培养体系中添加了VEGF。4周后Western Blot检测结果显示,无VEGF(无血管环境)培养的类器官维持软骨表型,表现为Col2a1/Sox9高表达。存在VEGF(血管环境)培养的类器官会激活肥大分化通路,表现为Col10a1/Mmp13表达量显著增加,软骨标志物表达量显著下调。以上结果说明血管化程度是软骨-骨分化的“开关”,是模拟天然组织从无血管(软骨)到富血管(骨)的梯度的关键(图3)。
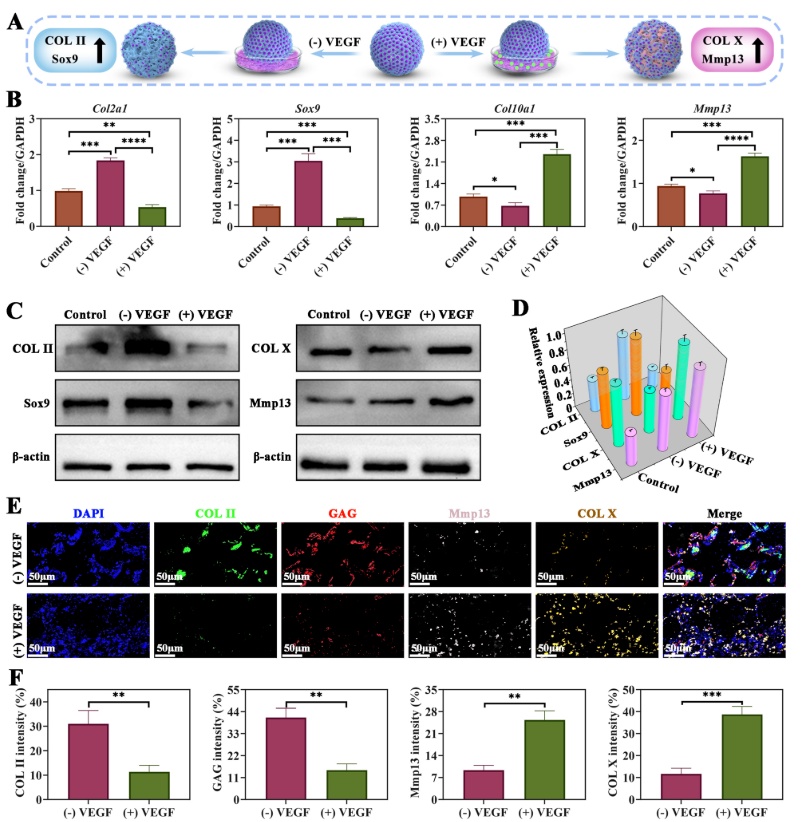
图3 VGF对软骨类器官的分化调控
四、血管微环境调控软骨类器官分化潜能的机制研究
为了进一步探究血管微环境调控软骨发育的机制,研究人员对VEGF处理前后的软骨类器官进行了RNA转录组测序,其中在VEGF组41个基因表达上调(如血管生成基因VEGFA/NOTCH1、成骨基因RUNX2/BMP2),12个基因表达下调(如软骨基因SOX9/COL2A1),上调基因富集于血管生成、骨化等信号通路,下调基因集中于软骨发育、TGF-β信号等信号通路(图4)。
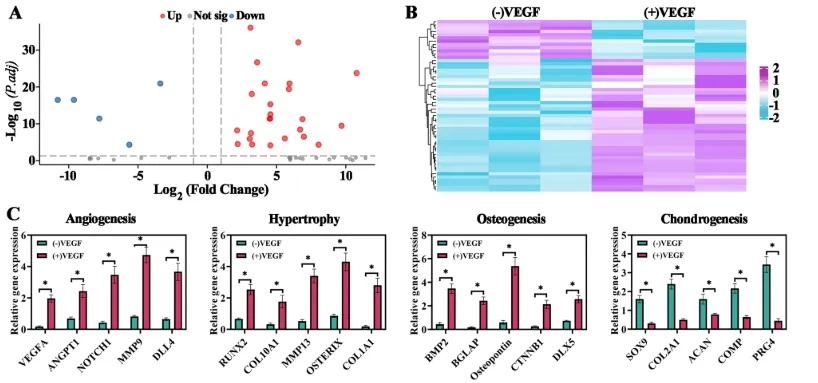
图4 有无VEGF培养骨类器官转录组分析结果
五、类器官/GelMA复合物体内成软骨与成骨活性评估
为了验证软骨类器官在体内的分化潜能,研究人员构建了双层GelMA支架包裹类器官,上层使用抗血管药物Axitinib处理以模拟无血管环境,下层无药物处理以模拟富血管环境。上层表现为软骨基质(GAG/COL II)丰富的环境,并且CD31血管标志物阴性。下层促进骨小梁形成,CD31血管标志物阳性,诱导骨形成。该结果证明体内条件下血管微环境具有空间特异性地调控类器官分化能力——无血管区促进软骨形成,富血管区促进成骨,进而模拟天然骨软骨梯度(图5)。
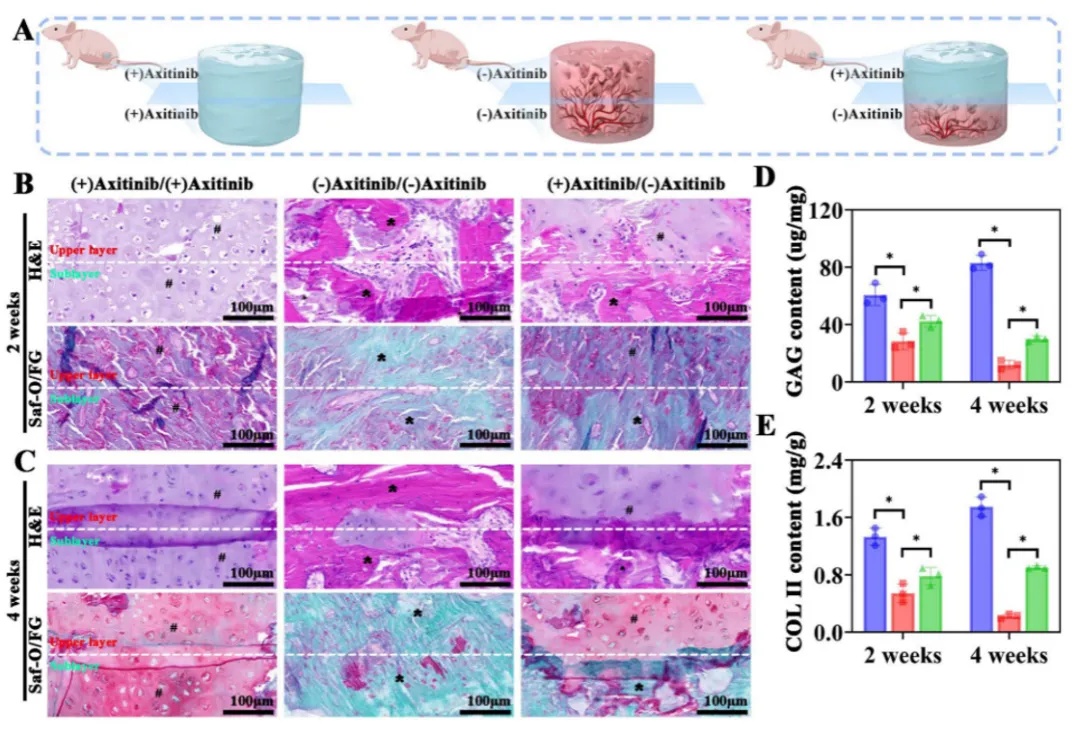
图5 血管微环境对类器官/GelMA复合物成软骨和成骨调控作用
六、类器官/GelMA复合物在兔OCD模型中的应用
研究人员在兔OCD模型的膝关节中植入梯度软骨类器官/GelMA圆柱体12周后,观察类器官修复作用。其中移植梯度软骨类器官/GelMA圆柱体的OCD兔膝关节缺损处形成明显的三层结构:上层透明软骨,中层钙化软骨过渡层,下层形成骨小梁接近于天然骨。在生物体内证明了通过仿生血管微环境可成功生成天然骨组织梯度(图6)。
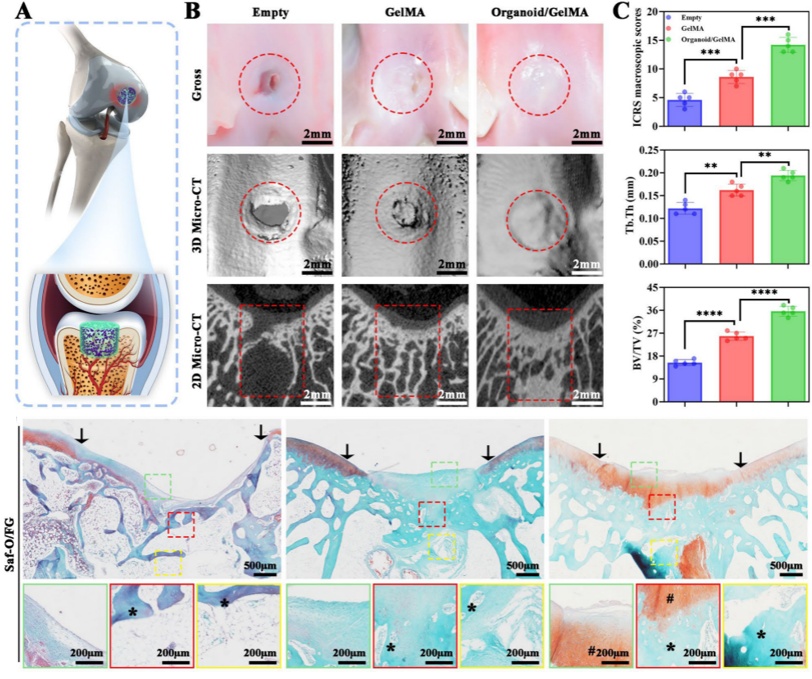
图6 兔OCD模型中梯度类器官/GelMA复合物促进梯度异质骨软骨再生
结 语:该研究利用BMSC成功构建出软骨类器官,并且探究了血管微环境对于软骨类器官发育的调控作用。证明了血管微环境可空间特异性地调控类器官分化——无血管区促进软骨形成,富血管区促进成骨。并且将这种梯度骨软骨类器官复合物移植到骨软骨缺损的兔膝关节处,实现精确的梯度异质骨软骨再生。该研究为骨软骨缺损的临床修复提供新的治疗方向。
- Previous article:NAC-Organ助力RNA疗法新突破:RNA替代蛋白疗法治疗高草酸尿症
- next:NAC-Organ技术:助力中医药现代化的革命性突破
