Room 810, 8F, No. 780, Cailun Road, Pudong New Area, Shanghai, China.
News Center
重磅消息!美国国立卫生研究院宣布停止资助纯动物研究!
2025年7月7日,美国国立卫生研究院(NIH)宣布,今后将不再专门征集涉及动物的研究项目提案。此前NIH已经多次明确鼓励研究人员设计涉及动物的项目,并于4月已经宣布了“优先考虑以人为本的研究技术”的倡议,并在与美国食品药品监督管理局(FDA)联合主办的首届“减少动物试验研讨会”上进行了分享。新的 NIH 资助项目都应侧重于非动物方法的新兴方法学(New Approach Methodologies,NAM),这套现代替代方案包括包括 AI 计算模型、人类细胞系、类器官以及器官芯片系统等。其中类器官与器官芯片将作为动物试验的核心替代方案。这一声明将彻底取消动物实验提上日程。

类器官(Organoid)是指利用成体干细胞或多能干细胞在体外三维(3D)培养条件下,通过细胞自组织与定向分化形成的微型器官模型。这类3D培养体系能够高度模拟真实器官的关键结构特征与生理功能。体外3D药物模型的发展经历了三十多年的演进历程。早在1992年,科学家们就开始研究球状体(spheroids)这一最初的3D细胞培养模型。2009年成为重要转折点,荷兰科学家首次成功培育出小肠类器官,为器官模拟技术奠定了基础。自首个肠道类器官以来,肝脏、胰腺、大脑等各类器官的类器官模型相继建立。2010年,肺器官芯片技术的出现标志着微流控技术与细胞培养的成功结合,开启了器官芯片时代。2022年6月,FDA修改相关法案,将体外模型确立为独立的临床前评估体系,这一政策变化具有里程碑意义。2022年8月,赛诺菲公司的Sutlimab药物以完全基于体外模型的药效数据成功获得FDA的IND批件,成为该技术临床转化的重要里程碑,证明了体外3D模型在药物开发中的实用价值。基于患者特异性类器官模型的建立使得科研人员能够更精准地揭示疾病机制、评估药物反应,为个性化治疗方案的开发提供了强有力的技术支撑。类器官的核心优势在于高相关性:误差率较动物试验显著降低,更准确的预测药物代谢与毒性。高效降本:2-4周完成毒性评估,较传统动物试验大幅缩短周期、降低成本。
随着对研究试验结果的需求提高,目前已经开发出具有功能血管网络类器官以及结合微流控技术定的多器官芯片系统,可实现类器官间的互联互通。器官芯片结合了微流控技术与细胞培养,能够在体外模拟复杂组织或器官的特征及生理功能。相较于单组织类器官模型,器官芯片能更好地重构生物屏障结构,维持更完整的组织微环境特征,并实现多器官系统的功能耦合与互作模拟,提升类器官的结构复杂度和生理功能,利用高仿真性的人体微生理系统预测人类对药物的真实反应(图1)。
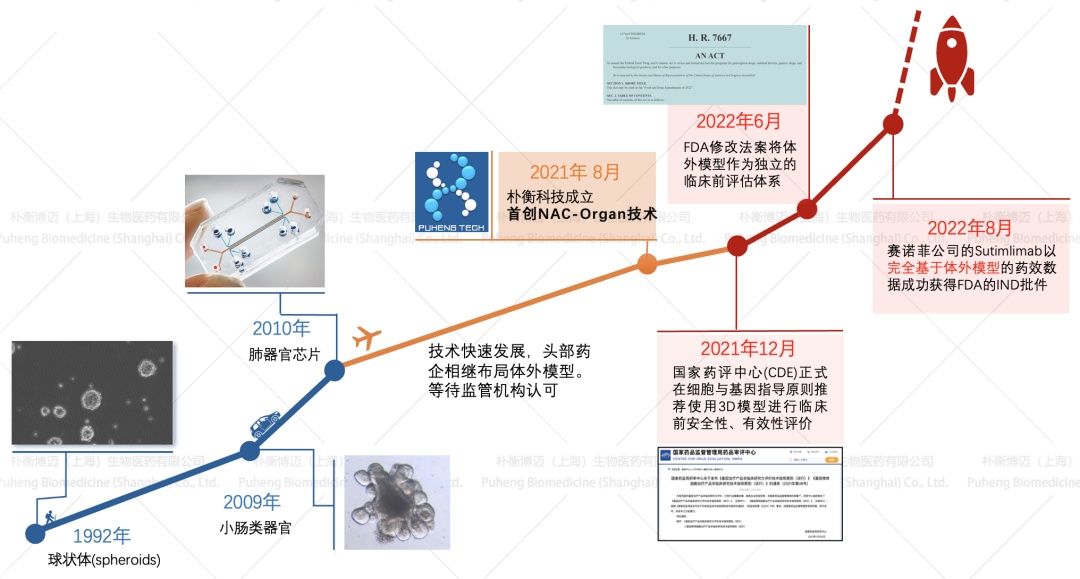
图1 体外3D药物模型发展
- Previous article:文献解读|人胚胎干细胞来源类器官通过肝窦内皮细胞调控实现肝脏分区特征
- next:朴衡博迈与中科未来生物技术研究院签署战略合作协议——加速新一代再生治疗技术的临床转化应用
