Room 810, 8F, No. 780, Cailun Road, Pudong New Area, Shanghai, China.
News Center
文献分享 | Nature最新研究成果:利用类器官技术实现人原代肝细胞的稳定扩增和肝脏分区模拟
update time:2025-06-04 09:14:06Number of clicks:1558
肝脏是人体中代谢功能最强大的器官,承担着药物代谢、胆汁酸合成、葡萄糖与脂质调控、解毒等多种关键任务。长期以来,人原代肝细胞(primary human hepatocytes, PHHs)因其高度成熟的功能,被视为构建体外肝脏模型的“黄金标准”。人原代肝细胞是最理想的肝病研究与药物开发工具,但是肝实质细胞在体外难以维持增殖和功能稳定性是一直以来亟待突破的问题,不能稳定扩增导致其长久依赖于捐献供体、应用成本极高,严重限制了其在药物研发、疾病建模和再生医学中的应用。过去几十年中,研究人员一直尝试利用包括类器官在内的各种新技术来实现人原代肝细胞的体外稳定扩增或者利用诱导多能干细胞(iPSC)、转分化技术等技术来建立替代性细胞来源。近日一项来自日本庆应大学医学部的研究发表在国际顶级期刊《Nature》上,题目为“Generation of human adult hepatocyte organoids with metabolic functions”。在这项研究中,研究人员利用一种名为Oncostatin M(OSM)细胞因子实现了在体外大规模扩增来源于成人肝实质细胞的肝脏类器官(human hepatocyte organoids, HHOs),并且可通过进一步的诱导分化来模拟肝脏不同分区特征。这一研究成果为解决人原代肝细胞扩增、培养难题提供了一个突破性的新思路,将促进功能化人肝细胞在多个领域的规模化应用,在这里我们为您带来这篇文章的精细化解读。
构建来源于成人肝细胞的类器官,实现长期扩增与表型维持
研究首先建立了来源于人原代肝细胞(PHHs)的三维类器官培养体系,形成可长期扩增的人肝类器官(HHOs)。通过优化培养体系,作者发现Oncostatin M(OSM)是实现类器官持续扩增的关键因子,不仅支持细胞存活与增殖,还能在一定程度上抑制胆管样分化趋势。在OSM支持下培养形成的HHOs,持续表达肝细胞标志物白蛋白(ALB),并建立明确的上皮极性结构(如ZO-1、CDH1等)。与之相对,缺乏OSM或在YAP信号抑制剂LATSi作用下,类器官易转向表达CK19等胆管标志物,提示细胞命运调控对培养条件高度敏感(图1)。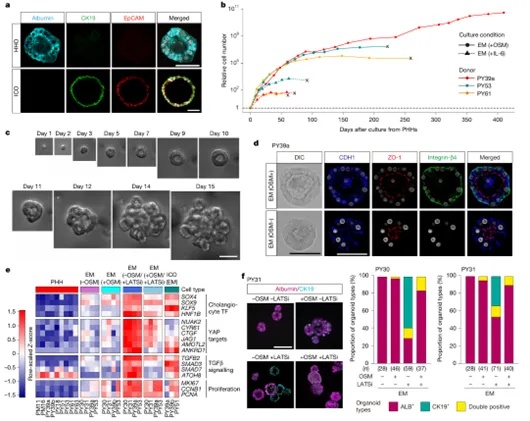
图1 通过特定因子扩增人源成人肝细胞类器官
HHOs在体内成功重建人源肝组织,具备代谢功能与空间分区特征
为了验证HHOs在体内的移植潜能,研究团队将扩增培养的HHOs移植至经药物诱导肝损伤的免疫缺陷小鼠(TK-NOG)肝脏中,并与传统的原代人肝细胞(PHHs)进行对比。结果显示,HHOs在小鼠肝组织中不仅能成功定植、形成界限清晰的人源细胞区块,还可持续表达人白蛋白(hALB),hALB水平随时间显著上升,说明HHOs具有稳定的体内功能输出能力。组织学分析进一步显示,移植的HHOs在结构上保留肝上皮细胞极性(Occludin、MRP2表达),并表现出空间上的代谢分化特征:在接近门静脉区域表达HAL(zone 1标志),靠近中央静脉区域表达CYP2E1(zone 3标志),高度模拟了肝脏代谢分区(zonation)的空间格局(图2)。相比原代肝细胞,HHOs在多位供体中均显示出良好的重建效率与组织整合性,表明该模型不仅适用于体外研究,也具备进一步应用于细胞替代治疗与肝功能重建的潜力。为再生医学领域提供了可靠的技术支撑。
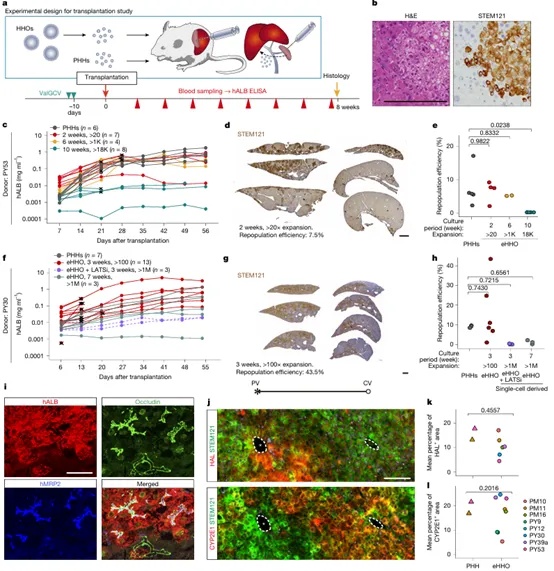
图2 HHOs在人肝损伤小鼠体内实现肝组织再生
HHOs模拟肝脏分区的功能特征
在获得扩增型HHOs(eHHOs)基础上,研究团队进一步开发了诱导其功能成熟的分化体系,形成了具备高度肝脏代谢活性的分化型类器官(dHHOs)。通过调整Wnt/R-spondin等信号因子,并结合禁食条件模拟体内代谢状态,dHHOs展现出明显的空间分区表达特征:靠近门静脉区域表达HAL等Zone 1标志,而靠近中央静脉区域则富集CYP2E1等Zone 3标志。功能检测显示,dHHOs形成了完整的上皮极性结构与胆小管网络(表达MRP2、CDH1、ZO-1),并在超微结构层面具备紧密连接与典型胆小管形态。配合三维成像技术,研究人员观测到胆汁酸可通过MRP2介导从类器官中排出,形成具有生理活性的胆汁流动。在代谢方面,dHHOs合成包括TCA、GCA、CDCA等在内的多种胆汁酸,并能响应脂质调控因子(如PPARα/γ激动剂),调节甘油三酯合成与脂滴形成。此外,dHHOs展现出多种CYP酶(如CYP1A2、CYP2C9、CYP3A4)的基础活性,并对对乙酰氨基酚(APAP)等肝毒性药物呈现典型的剂量依赖性毒性反应(图3)。这些结果证明,dHHOs不仅在分子层面保留肝细胞标志,更在功能输出层面模拟了成熟肝脏的核心代谢过程,是目前少有的同时具备结构与功能高度仿生性的体外人类肝模型。
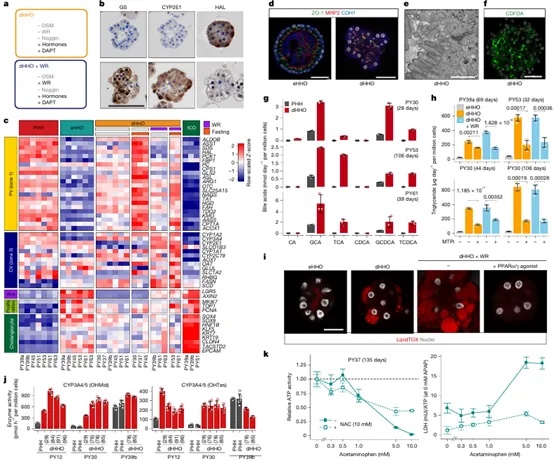
图3 HHOs具备成熟的肝脏代谢功能
HHOs重现肝脏代谢地图
为进一步确认分化型HHOs(dHHOs)是否具备成熟肝细胞的核心代谢功能,研究团队围绕“近门静脉区”肝细胞主导的代谢活动,开展了系统功能验证。结果显示,dHHOs在葡萄糖异生、尿素循环、氧代谢和蛋白合成方面均表现出高度仿生能力。在营养剥夺状态下,dHHOs可合成大量葡萄糖、尿素及酮体,其水平接近甚至优于传统的原代肝细胞(PHHs),且远超扩增型HHOs(eHHOs)。通过13C和15N标记的稳定同位素示踪实验,研究人员分别追踪到葡萄糖异生路径和尿素循环路径中碳氮转化的中间产物,进一步印证了其代谢完整性。在能量代谢方面,dHHOs的线粒体呼吸活性(OCR)检测表明其具有稳健的氧耗能力,提示其具备成熟的线粒体功能。同时,在合成分泌功能上,dHHOs能够持续表达并分泌白蛋白(ALB),并具备维生素K依赖性的凝血因子IX(FIX)活性,与体内肝细胞的蛋白合成功能相符(图4)。整体而言,这些结果证明dHHOs不仅在形态与分子水平模拟肝组织,还在核心代谢功能层面再现了近门静脉区肝细胞的关键生理活动,是迄今功能维度最全面、表现最稳定的体外人肝模型之一。
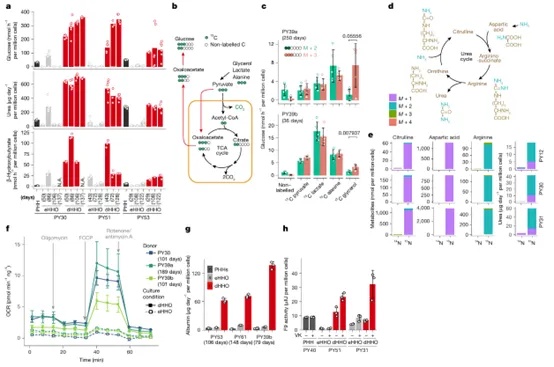
图4 门静脉周围肝细胞类器官的建立
基因编辑型HHOs构建实现肝遗传代谢病体外建模
在构建并验证功能型dHHOs之后,研究团队进一步拓展其应用潜力,将HHOs平台用于人类遗传性代谢病的体外建模。通过CRISPR-Cas9介导的基因敲除技术,研究者成功构建了靶向G6PC(葡萄糖异生相关)与OTC(尿素循环相关)的基因KO类器官。Sanger测序与蛋白质水平检测结果均证实了基因敲除的效率与特异性。与野生型(WT)HHOs相比,G6PC-KO类器官几乎完全失去了葡萄糖的生成能力,而OTC-KO类器官则显著降低了柠檬氨酸(citrulline)等尿素循环中间产物的合成,功能缺陷明确,表型高度一致于对应人类疾病。此外,两类KO HHOs均仍可分泌白蛋白,说明其总体结构和肝细胞身份未被破坏,具备作为疾病模型的稳定性和可重复性(图5)。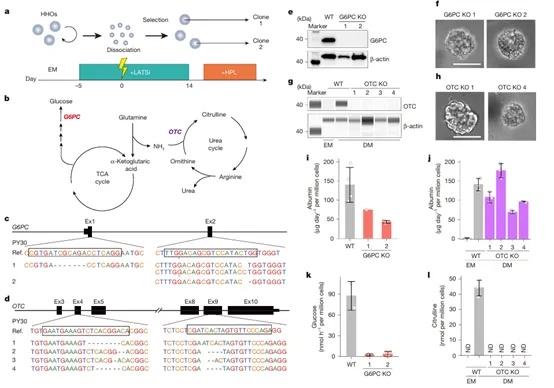
图5 基因敲除肝细胞类器官的生成
结语
这项研究成果为突破成人肝细胞体外长期扩增与维持功能的技术瓶颈提供了有力的技术支持,将类器官技术发展成为人原代肝细胞规模化扩增的成熟技术,构建出具备成熟代谢功能、可再分化、可移植的人类肝类器官(HHOs)体系,不仅为药物代谢与毒理研究提供了更稳定、更真实的模型,也为代谢性肝病的体外建模与细胞替代疗法奠定了坚实基础。原文:Igarashi, R., Oda, M., Okada, R. et al. Generation of human adult hepatocyte organoids with metabolic functions. Nature (2025). https://doi.org/10.1038/s41586-025-08861-y
- Previous article:产品介绍:朴衡博迈原代肝细胞、肝脏类器官系列培养基全面上线!
- next:文献分享 | 基于干细胞技术的3D生物打印“微型肝脏”,为肝衰竭治疗开辟新路径
