Room 810, 8F, No. 780, Cailun Road, Pudong New Area, Shanghai, China.
新闻动态
核酸材料助力骨关节炎治疗新突破 | 新型纳米药物精准狙击关节炎症

骨关节炎(Osteoarthritis, OA)是一种全球高发的慢性退行性关节病变,因其导致的进行性疼痛、关节畸形及功能障碍,严重影响人类生活质量。当前骨关节炎治疗以症状缓解为主(如镇痛、抗炎),缺乏有效逆转软骨退变的疾病修饰疗法(DMOADs),且长期用药存在胃肠/心血管副作用,手术治疗(如关节置换)创伤大、费用高,难以满足个性化及早期干预需求。
近日,朴衡博迈研发团队与复旦大学附属中山医院展开合作,利用朴衡博迈先进的核酸纳米材料设计与合成技术,开发了能够高效靶向治疗骨关节炎的新型纳米药物。该研究成果《DNA Origami-Based CD44-Targeted Therapy Silences Stat3 Enhances Cartilage Regeneration and Alleviates Osteoarthritis Progression》正式发表于《Advanced science》(IF 14.3/Q1)期刊,朴衡博迈联合创始人华东师范大学裴昊教授与复旦大学附属中山医院马春辉教授、阎作勤教授为该研究的共同通讯作者。为解决骨关节炎的靶向治疗难题,研究团队首次将可编程的DNA折纸材料应用于骨关节炎治疗,设计了一种利用CD44 DNA适配体靶向软骨细胞的递送系统(OCS),通过在其多面体结构核心装载针对Stat3的siRNA,实现主动靶向OA软骨细胞递送siRNA以抑制Stat3/MMP13降解轴,从而抑制炎症、激活SOX9/COL-II通路促进软骨再生。该研究不仅实现了对OA软骨细胞的精准治疗,还建立了利用核酸纳米材料开发关节软骨损伤精准治疗药物的设计新范式。
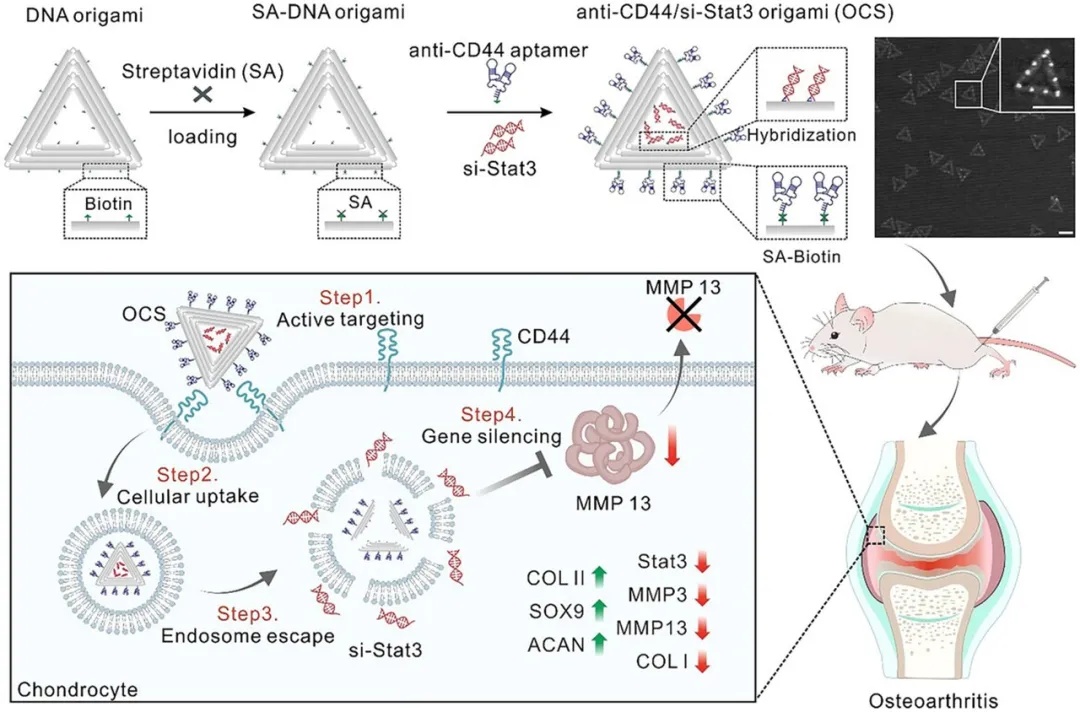
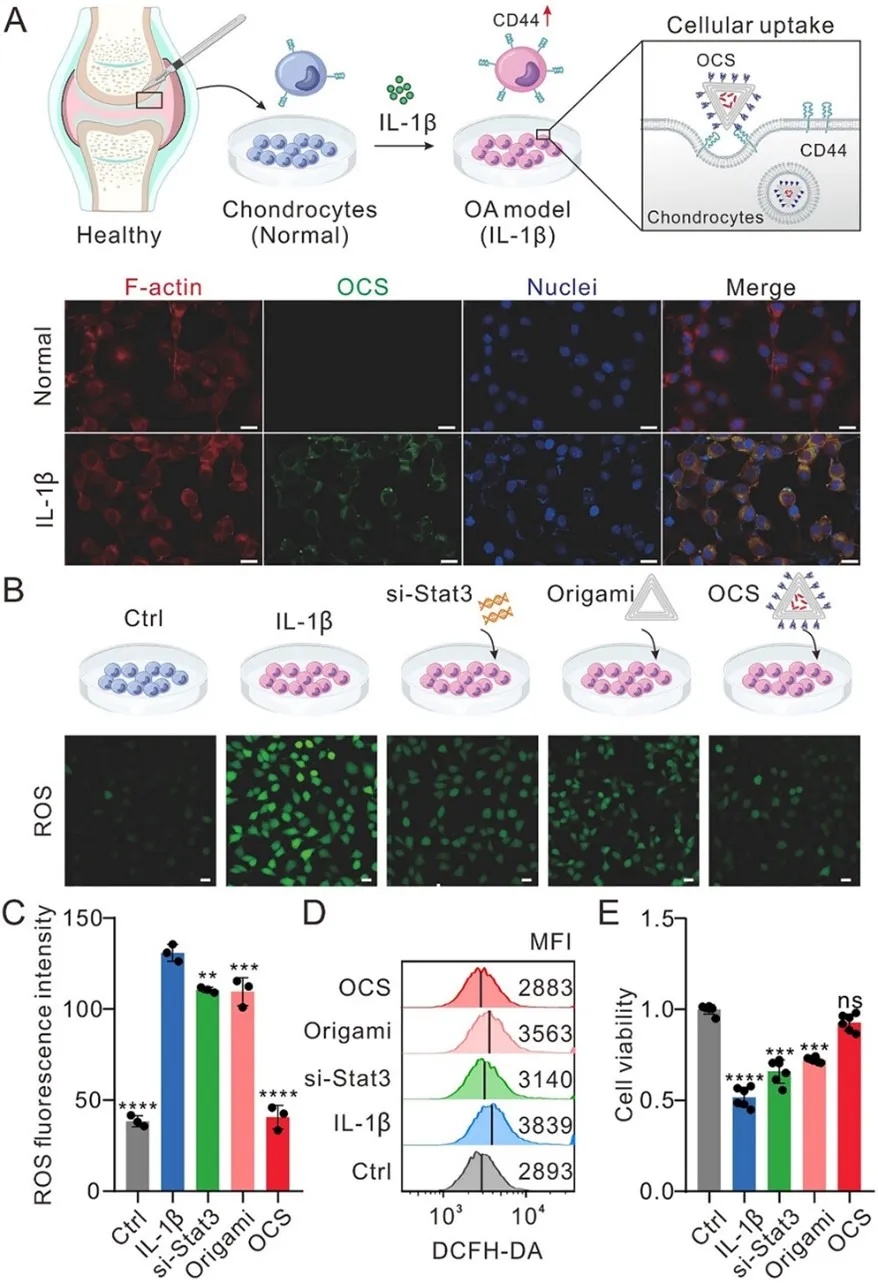
图 2 OCS 的细胞摄取、抗氧化特性和细胞保护作用。A)在正常和炎症条件(由 IL - 1β 诱导)下,OCS 在软骨细胞中细胞摄取的示意图和代表性共聚焦图像。细胞骨架用鬼笔环肽标记(红色),OCS 用异硫氰酸荧光素(FITC)标记(绿色),细胞核用 DAPI 复染(蓝色)。比例尺:20 μm。B)用 si - Stat3、折纸结构和 OCS 孵育 24 小时后,骨关节炎软骨细胞中活性氧(ROS)表达水平的示意图和代表性共聚焦图像。对照组:未受 IL - 1β 诱导或处理的健康软骨细胞;IL - 1β 组:IL - 1β 诱导的软骨细胞。C)不同处理后软骨细胞中 ROS 表达水平的相对荧光强度分析。数据以平均值 ± 标准差(n = 3)表示。D)不同处理后软骨细胞中 ROS 水平的流式细胞术分析。E)通过 CCK - 8 法检测不同处理 24 小时后软骨细胞的细胞活力。数据以平均值 ± 标准差(n = 6)表示。采用单因素方差分析进行统计学比较。**p < 0.01,***p < 0.001,****p < 0.0001,ns 表示无统计学意义。骨关节炎示意图(A)改编自 Liu 等人,《信号转导与靶向治疗》,8 卷,138 页(2023 年),遵循 CC BY 4.0 许可协议
研究团队通过IL-1β诱导软骨细胞模拟OA病理环境,并在OA模型中评估了OCS的靶向能力与治疗效果。图2结果表明,抗CD44适配体介导的OCS可特异性结合并进入OA造模的软骨细胞,而在健康软骨细胞中摄取量显著较低,凸显了其靶向递送的高效性,且时间序列追踪揭示OCS通过溶酶体途径实现si-Stat3的有效释放。实验数据显示,OCS纳米系统对IL-1β诱导的氧化损伤有明显改善作用。在活性氧(ROS)水平检测中,OCS处理组(108.3%)与健康对照组(100%)无显著差异,而游离si-Stat3(142.7%)和空白DNA折纸载体(135.4%)组仍维持高氧化应激状态。此外,CCK8增殖实验表明,OCS可几乎完全逆转IL-1β导致的细胞生长抑制(恢复率达91.4%),显著优于游离si-Stat3的有限修复效果(68.2%)。以上结果表明OCS实现对病变软骨细胞的精准定位,而折纸结构的溶酶体逃逸设计确保siRNA高效胞质释放,从而系统性抑制Stat3/MMP13信号轴,重建软骨微环境稳态。该研究为骨关节炎的靶向基因治疗提供了兼具时空精准性与生物安全性的创新解决方案。
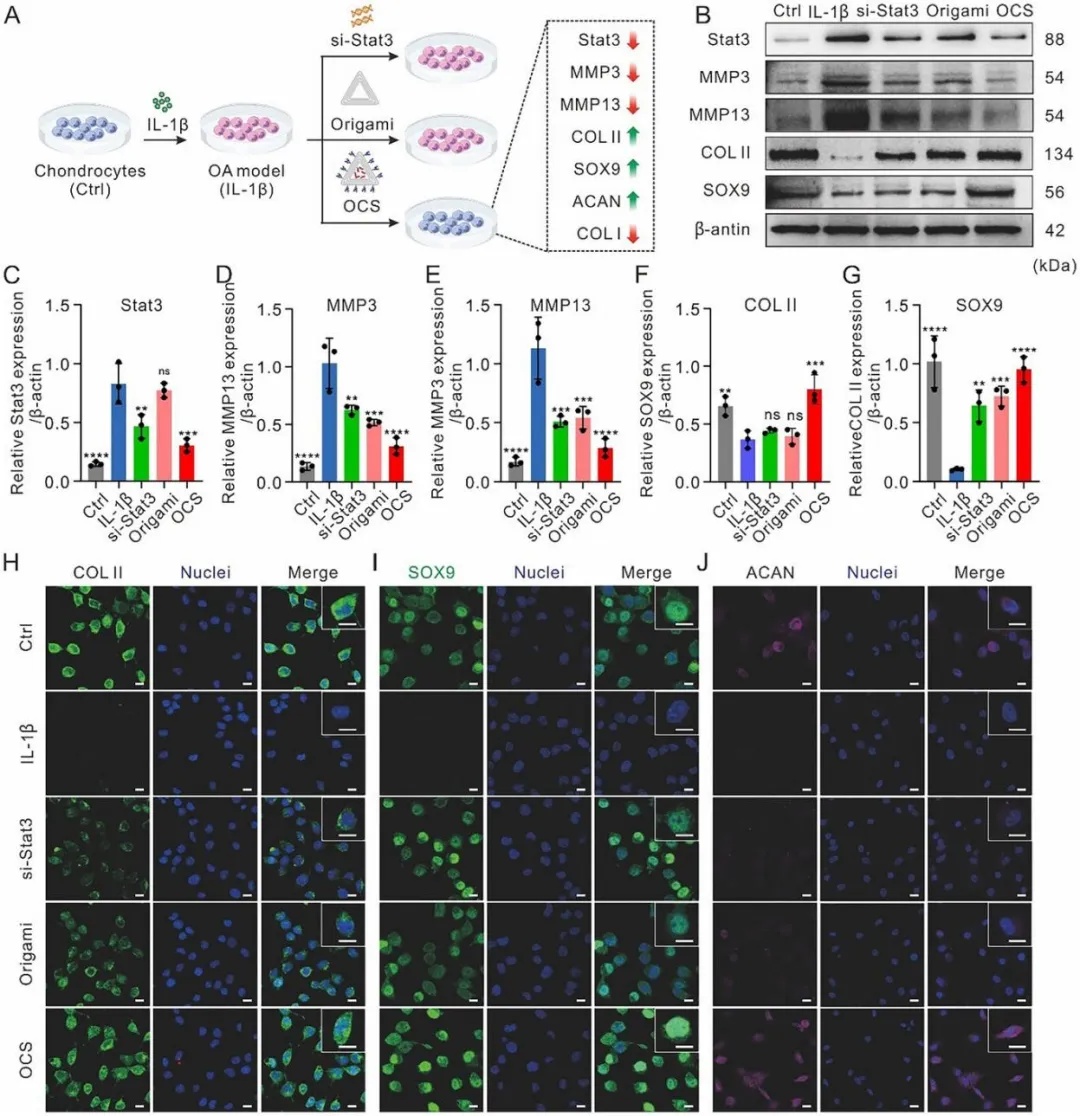
图 3 OCS 调节骨关节炎(OA)软骨细胞中的分解代谢和合成代谢蛋白。A)通过 IL - 1β 诱导在大鼠软骨细胞中建立细胞 OA 模型,随后用 si - Stat3、折纸结构(Origami)和 OCS 处理的示意图。对照组:未受 IL - 1β 诱导或处理的健康软骨细胞;IL - 1β 组:IL - 1β 诱导的软骨细胞。B)不同处理后软骨细胞中 Stat3、MMP3、MMP13、COL - II 和 SOX9 蛋白表达的蛋白质免疫印迹分析。C - G)蛋白质免疫印迹结果的定量分析。数据以平均值 ± 标准差(n = 3)表示。采用单因素方差分析进行统计学比较。**p < 0.01,***p < 0.001,****p < 0.0001,ns 表示无统计学意义。H - J)不同处理后软骨细胞中 COL - II、SOX9 和 ACAN 蛋白表达的代表性免疫荧光图像。比例尺:20 μm。
团队进一步从分子机制层面探究其治疗作用,通过IL-1β诱导建立大鼠软骨细胞OA模型。结果显示(图3),OCS能够有效抑制炎症相关蛋白(Stat3、MMP3、MMP13)的表达,同时显著上调软骨合成标志物(COL-II、SOX9)的水平。免疫荧光染色进一步证实,OCS处理组的COL-II、SOX9和ACAN表达明显增强,说明其不仅能够减轻软骨降解,还能促进软骨基质的合成与修复。这些结果表明,OCS通过精准调控炎症与合成代谢通路,有效减轻软骨降解、促进基质合成并抑制纤维化,为骨关节炎治疗提供了兼具靶向性与软骨保护效能的创新策略。
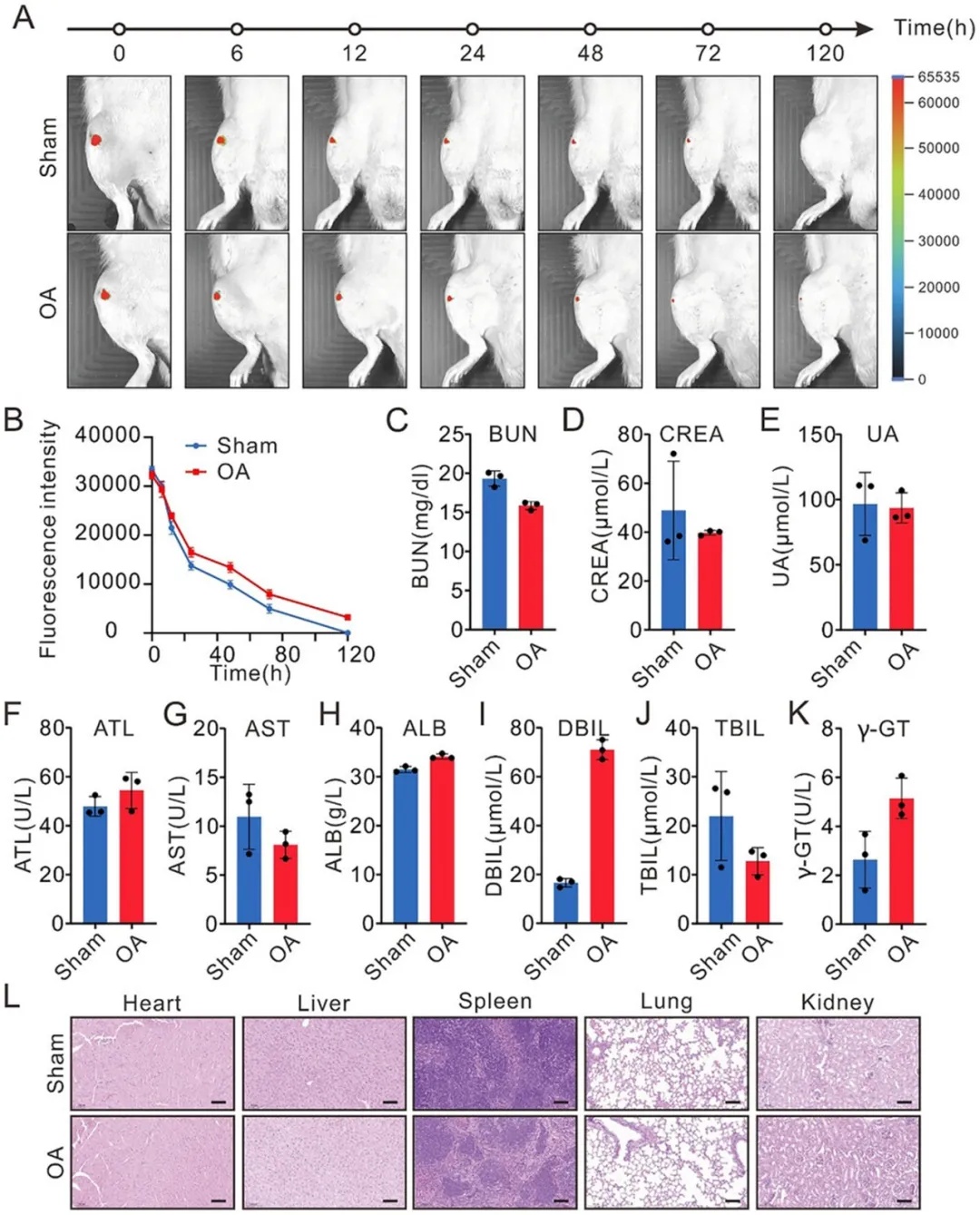
图 4. OCS 在大鼠体内的分布及生物安全性。A)假手术组(Sham)和骨关节炎(OA)大鼠关节腔内注射 FITC 标记的 OCS 后,不同时间点膝关节的代表性体内荧光图像(每组 n = 3 )。B)对 A 中荧光辐射的定量分析。C - E)肾功能的血液生化指标,BUN:血尿素氮,CREA:肌酐,UA:尿酸。数据以平均值 ± 标准差表示(n = 3 )。F - K)大鼠肝功能检测指标。ATL:丙氨酸转氨酶,AST:天冬氨酸转氨酶,ALB:白蛋白,DBIL:直接胆红素,TBIL:总胆红素,γ - GT:γ - 谷氨酰转移酶。数据以平均值 ± 标准差表示(n = 3 )。L)OA 组和假手术组大鼠主要器官的代表性苏木精 - 伊红(H&E)染色图像。比例尺:100 μm。
为了评估OCS的体内分布与安全性,作者通过活体成像技术,发现OCS在骨关节炎关节腔内注射后,OCS能特异性富集于OA关节并长期滞留,而在健康关节中无明显富集。血液生化指标(肝肾功能)和组织学分析均未发现OCS对主要器官的毒性作用(图4)。以上结果表明该递送系统具有良好的靶向性和安全性,为OCS作为安全高效的骨关节炎治疗策略提供了重要依据。
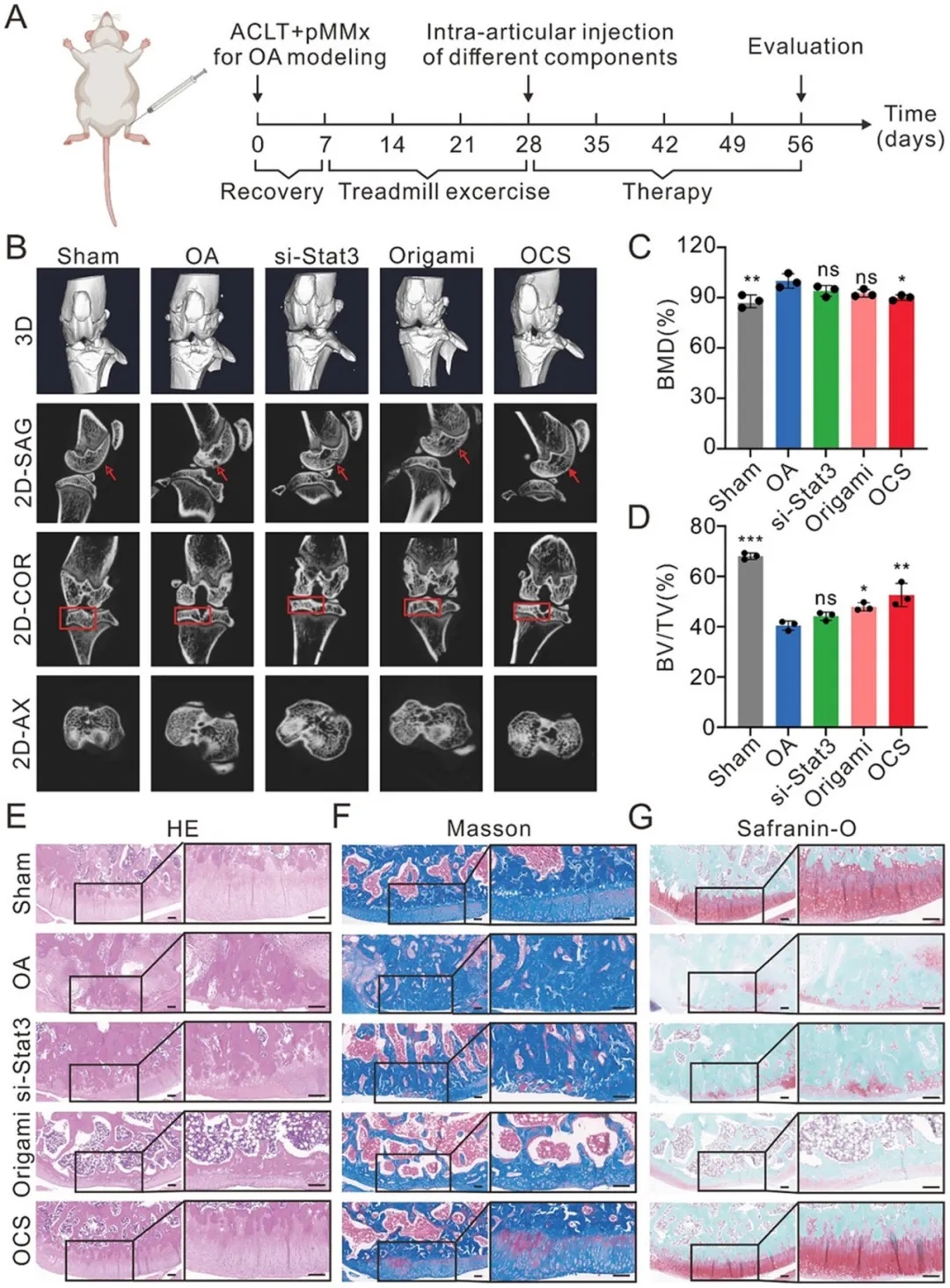
图 5 OCS 在大鼠骨关节炎(OA)模型中对关节软骨的治疗作用。A)实验设计示意图。采用前交叉韧带横断术(ACLT)和内侧半月板部分切除术(pMMx)手术技术建立 OA 模型。四周后,每周进行关节腔内注射,分别注射生理盐水、si - Stat3、折纸结构或 OCS,共注射四次。在第九周,通过显微 CT 成像和组织学染色评估软骨恢复情况。假手术组(Sham):仅分离皮肤和肌肉,关节结构保持完整。OA 组:注射生理盐水。B)膝关节的代表性三维显微 CT 图像以及冠状面(COR)、矢状面(SAG)和轴面(AX)的二维图像。C、D)胫骨软骨下骨参数的定量分析:骨矿物质密度(BMD)和骨体积 / 组织体积(BV/TV)。数据以平均值 ± 标准差表示(n = 3 )。采用单因素方差分析进行统计学比较。*p < 0.05,**p < 0.01,***p < 0.001,****p < 0.0001,ns 表示无统计学意义。E - G)膝关节的组织学分析,包括苏木精 - 伊红(H&E)染色、Masson 染色和番红 O 染色。右侧照片为黑色矩形区域的高倍放大图。比例尺:200 μm。
团队在良好的生物安全性基础上,进一步测评了体内治疗效果。采用前交叉韧带切断术(ACLT)联合内侧半月板部分切除术(pMMx)构建大鼠OA模型,术后每周关节注射OCS共4周。Micro-CT显示OCS能显著抑制OA相关的软骨下骨异常重塑(如骨密度增加、骨体积变化)。组织学染色(H&E、Masson、Safranin-O染色)进一步证实OCS可减轻软骨降解、减少滑膜增厚和纤维化,并促进蛋白聚糖的保留,其效果优于单纯si-Stat3或Origami治疗。这些结果表明, OCS在体内实验中展现出优于其他治疗组的骨关节炎改善效果,为骨关节炎治疗提供了兼具靶向性与结构修复效能的创新策略。
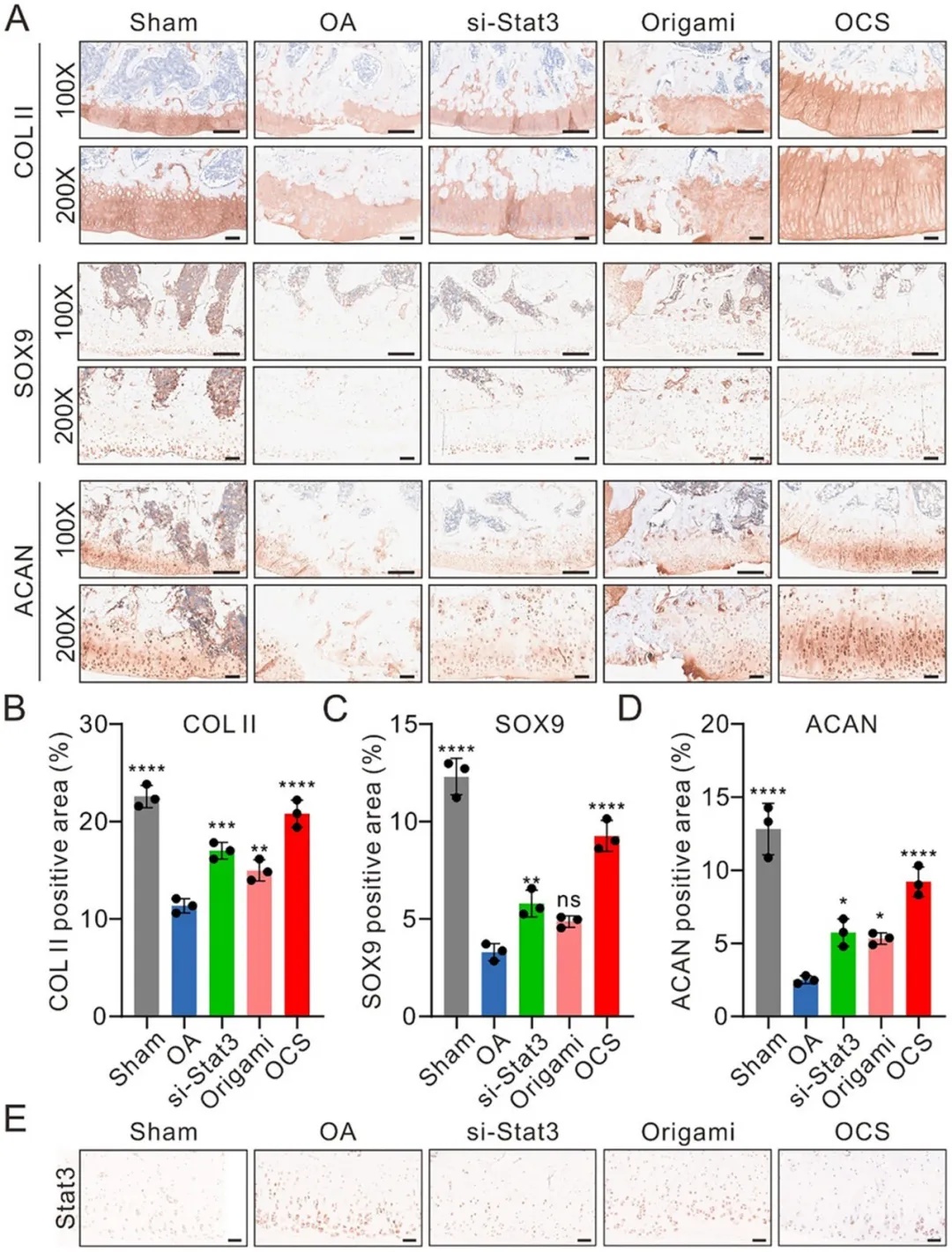
图6 治疗四周后,大鼠不同治疗组膝关节的免疫组化(IHC)染色。A)不同治疗条件下,大鼠软骨切片中 II 型胶原蛋白(CoL - II)、SOX9 和聚集蛋白聚糖(ACAN)的代表性免疫组化染色图像。比例尺:500 μm。B)由 A 计算得出的 CoL - II 阳性(CoL II⁺)面积。C)由 A 计算得出的 SOX9 阳性(SOX9⁺)面积。D)由 A 计算得出的 ACAN 阳性(ACAN⁺)面积。数据以平均值 ± 标准差表示(n = 3 )。采用单因素方差分析进行统计学比较。*p < 0.05,**p < 0.01,***p < 0.001,****p < 0.0001,ns 表示无统计学意义。E)不同治疗条件下,大鼠软骨切片中 Stat3 的代表性免疫组化染色图像。比例尺:100 μm。
基于组织病理学评估,OCS在骨关节炎大鼠模型中展现出显著的软骨表型修复能力。结果显示(图6),与未治疗OA组相比,OCS干预使软骨特异性标志物呈现生理性分布特征:Ⅱ型胶原(COL-II)在胞浆内形成连续网络结构,蛋白聚糖(ACAN)实现软骨深层的梯度重建,同时SOX9作为软骨分化核心转录调控枢纽,其核内富集度提升2.1倍。相较于游离si-Stat3或空白载体组,OCS对基质合成的促进作用更为显著(COL-II表达量提升58%,ACAN沉积增加43%)。机制层面,OCS通过高效沉默Stat3(免疫活性降低67%),精准抑制MMP13介导的胶原降解轴,逆转ECM代谢失衡。该研究首次在活体层面证实,DNA纳米载体可通过多维度调控(表型维持+炎症抑制+基质再生)实现关节稳态重建,为开发下一代智能型骨关节炎疗法奠定理论基础。
总 结
该研究首次将DNA折纸技术应用于OA的靶向基因治疗,通过在其多面体结构核心装载针对Stat3的siRNA,并共价结合抗CD44 DNA适配体,主动靶向OA软骨细胞,有效递送siRNA并沉默Stat3,从而抑制炎症、促进软骨再生,实现了对OA软骨细胞的精准治疗。原文链接:https://doi.org/10.1002/advs.202503939
- Previous article:文献分享 | 基于干细胞技术的3D生物打印“微型肝脏”,为肝衰竭治疗开辟新路径
- next:朴衡MASH模型助力揭示肝纤维化“关键通路”,GPR91成为潜在治疗新靶点
