上海市浦东新区蔡伦路780号8层810室
新闻动态
3D免疫肿瘤学模型研究的最新进展

文献原名:Harnessing 3D in vitro systems to model immune responses to solid tumours: a step towards improving and creating personalized immunotherapies
期刊:nature review immunology
IF:100.3
发表时间:2023.7.4
通讯作者:孙伟&庞媛
通讯作者单位:Biomanufacturing Center, Department of Mechanical Engineering, Tsinghua University, Haidian District, Beijing, China
DOI号:10.1038/s41577-023-00896-4

近日,清华大学机械工程系生物制造团队庞媛/孙伟在Nature Reviews Immunology上在线发表了题为 “Harnessing 3D in vitro systems to model immune responses to solid tumours: a step towards improving and creating personalized immunotherapies”的综述文章。作者阐明传统肿瘤建模系统:文章对体外三维建模技术,以及如何应用这些3D模型来开发免疫检查点抑制剂(CIC)、测试和优化免疫疗法进行了系统的介绍。
免疫-肿瘤相互作用传统模型的局限性
体外2D培养和小鼠模型已用于肿瘤免疫学和免疫治疗研究数十年,但是单层细胞不具有3D结构,缺乏人类恶性肿瘤的复杂免疫学。最近研发的人源化免疫小鼠模型用于人类免疫系统重建,但这些小鼠模型的免疫相容性和高通量应用具有极大挑战。且2D培养和动物模型均难以实现药物输送系统的多级控制,简单的2D系统无法反映实体瘤中的生化和物理屏障施加的递送干扰,小鼠模型中过强的远隔效应无法保证生物安全性。此外,这两种类型的模型都不能准确复制免疫相关的不良事件。
基于此,研发能替代临床前或临床模型对于精准概括肿瘤-免疫周期、评估免疫疗法和优化免疫疗效,同时减少不良事件至关重要。体外3D 培养组织器官是近年来生物医学领域的一项突破性创新技术,3D模型的出现为肿瘤免疫学和免疫疗法提供了全新的视角。
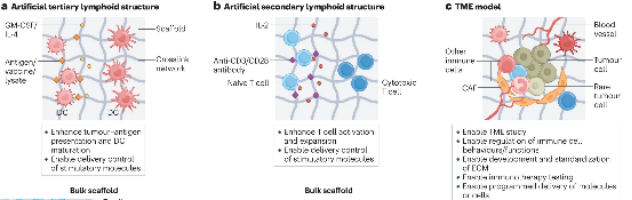
图1:用于肿瘤免疫学研究的基于支架的三维模型示意图(来源:Nat Rev Immunol)
3D免疫肿瘤模型技术
基于支架的3D肿瘤微环境模型
在基于支架的三维模型中,细胞被植入到模拟实体组织的细胞外基质(Extracellular Matrix, 简称ECM)的生物材料中(图1)。细胞接种是在微孔或纤维支架上进行的,支架平台可对递送的免疫调节剂和免疫细胞之间的相互作用进行时空调节,并重现免疫细胞的串扰。
类器官模型
肿瘤类器官是源自原代肿瘤组织(或基因工程干细胞)的自组织微型3D细胞聚集体,具有保留亲本肿瘤组织的关键分子和结构特征的能力。通过加入各种免疫细胞成分,构建肿瘤免疫类器官模型。
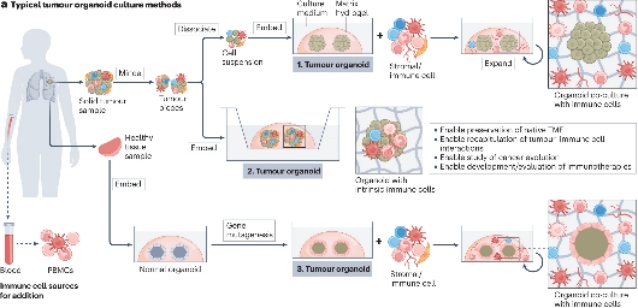
图2:用于肿瘤免疫学研究的肿瘤类器官模型示意图(来源:Nat Rev Immunol)
微流控模型
微流体3D模型使用仿生生物学和微细加工技术的组合,通过空间调控的共培养、灌注流和信号梯度的空间控制,微流体已发展成为进一步加强3D细胞培养生理相关性的多功能工具。目前,常见的微流体三维模型构建方法包括三维水凝胶、液滴和柱状培养(图3)。
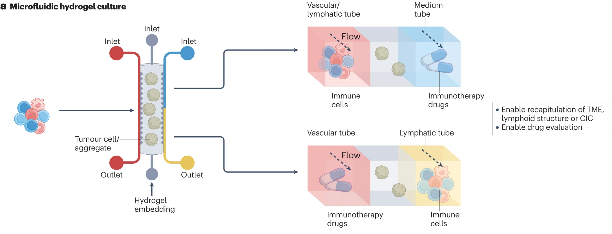
图3:用于肿瘤免疫学研究的微流控三维模型示意图(来源:Nat Rev Immunol)
3D生物打印
与在微流体芯片中预先确定的微框架内部署各种元件不同,生物打印可在完全开放的空间内自由有序地组装这些元件。生物打印通过将细胞或聚集体融入天然或合成ECM来构建人工组织(图4)。根据预定设计,将癌细胞、基质细胞和免疫细胞以及三维空间中的物理和生化梯度的一致排列,系统地研究TME中的细胞-细胞和细胞-ECM之间的相互作用。
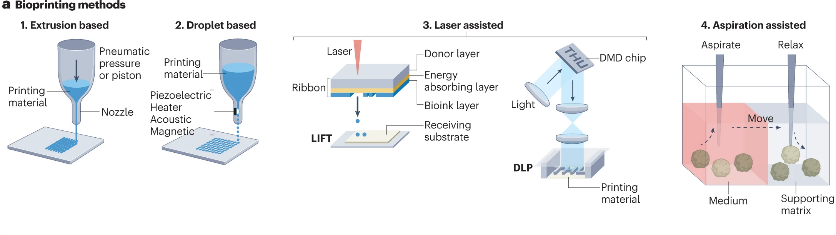
图4:用于肿瘤免疫学研究的基于生物打印的三维模型示意图(来源:Nat Rev Immunol)
成功构建体外三维免疫肿瘤学模型不仅有利于重塑传统的免疫肿瘤学研究方法,还有助于加速临床有效免疫疗法的转化,从而大大改善患者的肿瘤预后。
NAC-Organ3D实体瘤模型
朴衡科技基于合成生物学技术研发的NAC-Organ体外3D培养技术,能够24小时内实现1000至1百万数量级的体外3D实体瘤模型构建(图5)。并且能够构建侵入型、组装型两种免疫微环境模型,为药物筛选和机制研究提供标准化、高通量的体外3D实体瘤模型。
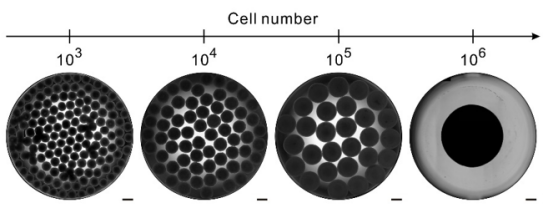
图5:不同细胞数量组装的NAC-Organ肿瘤模型。
NAC-Organ组装型侵入型微环境3D模型
利用NAC-Organ技术将免疫细胞与肿瘤细胞组装,构建肿瘤细胞与免疫细胞共培养的3D免疫微环境(图6-7)。
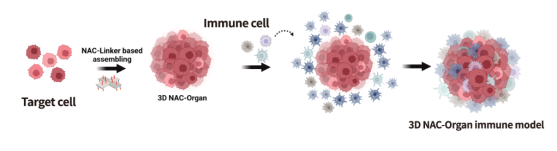
图6:侵入性免疫微环境模型示意图。
应用:基于NAC-Organ系统评估CAR-MACROPHAGE细胞靶向、侵入、杀伤效果。

图7:NAC-Organ系统监测CAR-/+Macrophage(绿色)细胞靶向、侵入肿瘤模型瘤体的能力。
NAC-Organ组装型免疫微环境3D模型
技术可以整合原肿瘤病灶内的免疫细胞,造模时间短,免疫细胞活性高,并且体外培养方便补充外源免疫细胞进行免疫疗法药物的评价,成本低且操作简单,更有利于进行高通量的药物检测(图8-9)。
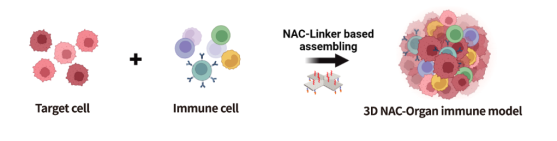
图8:组装型免疫微环境模型示意图。
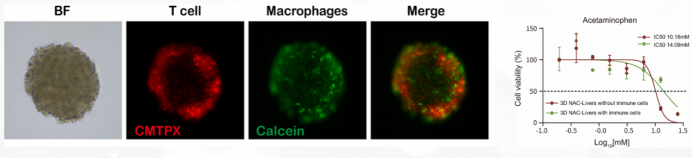
图9:NAC-Organ免疫微环境模型:将T细胞、巨噬细胞引入制备的3D模型,免疫细胞的引入对药效具有显著的影响。
