上海市浦东新区蔡伦路780号8层810室
新闻动态
文献分享 | 基于干细胞技术的3D生物打印“微型肝脏”,为肝衰竭治疗开辟新路径

肝脏作为人体内最大的实质性器官,承担着代谢、解毒、合成等核心生理功能,然而急性肝衰竭和终末期肝病面临供体肝脏短缺、传统组织工程方法功能维持不足等严峻挑战。北京大学邓宏魁教授团队与清华大学庞媛教授团队近期在《Gut》发表题为《Bioprinting functional hepatocyte organoids derived from human chemically induced pluripotent stem cells to treat liver failure》的研究论文。为突破人原代肝细胞体外扩增限制并构建可移植的功能性肝组织,团队开发了化学诱导多能干细胞(hCiPSCs)定向分化结合3D球体生物打印的创新技术:通过透氧微孔装置规模化培养高活性肝细胞类器官(hCiPSC-HOs),其存活率超90%且核心功能接近原代肝细胞;继而以GelMA水凝胶为载体,采用球体生物打印技术构建高密度细胞相互作用的3D肝微组织(3DP-HOs),解决了传统单细胞打印的细胞离散和功能衰减问题。体内实验证实,3DP-HOs移植显著改善两种肝衰竭小鼠模型的预后,并促进肝组织血管化重建、抑制纤维化且恢复白蛋白分泌等核心功能。该研究首次实现非基因编辑干细胞与生物打印技术的结合,构建出兼具功能成熟度与体内移植可行性的“微型肝脏”,为肝衰竭治疗提供了从细胞来源到组织构建的全解决方案,推动肝脏再生医学向临床应用迈出关键一步。
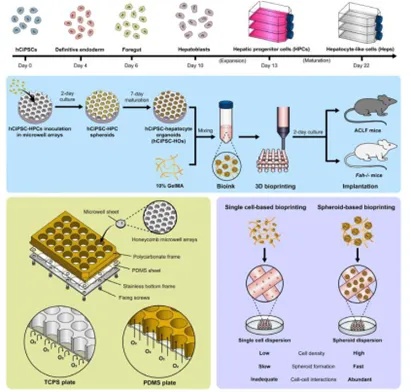
为开发治疗肝衰竭的功能性肝组织,研究团队提出了一种创新策略:将化学诱导多能干细胞衍生的hCiPSC-HOs与球体生物打印技术相结合,构建高细胞密度的3DP-HOs(图1)。研究利用聚二甲基硅氧烷(PDMS)基微孔装置规模化培养类器官,通过优化氧气供应显著提升了hCiPSC-HOs的存活率和生物功能。进一步通过球体生物打印技术将hCiPSC-HOs与GelMA水凝胶结合,形成具备丰富细胞间相互作用的3DP-HOs。
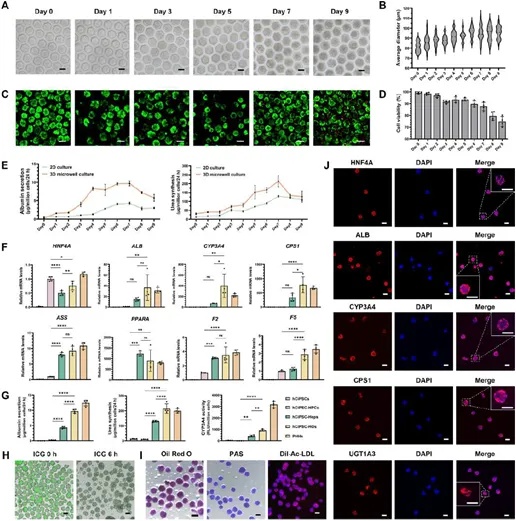
研究通过透氧微孔装置成功实现了高功能hCiPSC-HOs的规模化生成。以化学诱导多能干细胞来源的肝祖细胞(hCiPSC-HPCs)为起始材料,接种于聚二甲基硅氧烷(PDMS)基微孔阵列后,细胞在2天内自组装成球体。与传统聚苯乙烯培养板相比,透氧装置显著提升了细胞球体的平均直径和存活率。hCiPSC-HOs在白蛋白分泌、尿素合成及药物代谢相关基因(HNF4A、CYP3A4等)表达上显著优于2D培养的肝细胞样细胞(hCiPSC-Heps),且与原代人肝细胞(PHHs)功能相当。此外,hCiPSC-HOs表现出典型的肝细胞生物学功能,包括ICG摄取与释放、脂质代谢及胆汁酸转运结构形成(图2)。
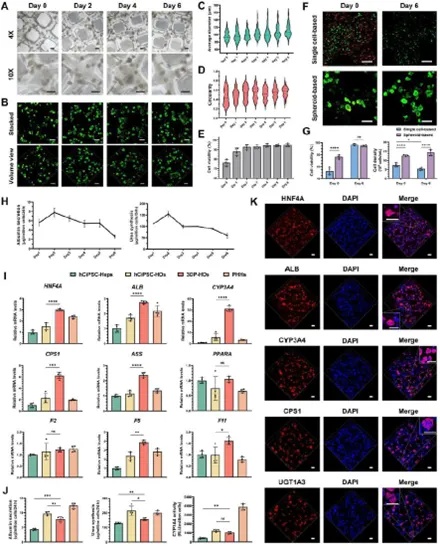
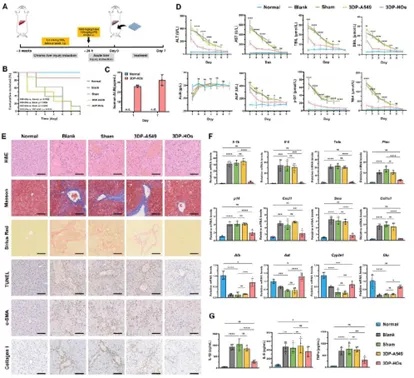
根据结果,移植3DP-HOs的小鼠7天存活率达85.7%,显著高于假手术组(0%)、空白组(0%)和3DP-A549组(0%),且与正常对照组无差异。血清检测显示,3DP-HOs移植后人白蛋白持续表达,肝损伤标志物(ALT、AST、TBIL等)在7天内恢复至正常水平,显著优于对照组。组织学分析表明,3DP-HOs组肝组织坏死和充血区域减少,凋亡细胞(TUNEL阳性)及纤维化相关指标(α-SMA、Collagen I)显著降低,同时肝功能相关基因(Alb、Cyp2e1)表达上调,炎症因子(IL-1β、TNF-α)分泌减少。多供体验证实验中,不同性别来源的hCiPSCs衍生的3DP-HOs均表现出一致的高存活率,证实了该疗法的普适性。此外,3DP-HOs移植还促进了肾肺功能恢复。综上,3DP-HOs通过提升存活率、改善肝功能、抑制炎症和纤维化,为ACLF治疗提供了高效的解决方案(图4)。
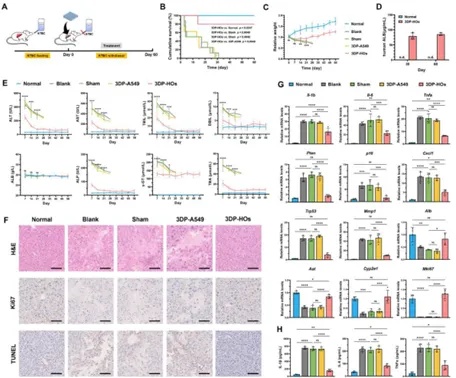
移植3DP-HOs的Fah−/−小鼠在60天观察期内存活率达80%,显著高于Sham组(0%)、空白组(0%)及3DP-A549组(0%),且体重维持稳定并逐渐恢复至正常水平。血清检测显示,移植后30天和60天的人白蛋白(hALB)水平持续升高,表明3DP-HOs在体内长期维持肝脏功能。肝损伤标志物(ALT、AST、TBIL等)在3DP-HOs组显著低于对照组,且肝组织H&E染色显示坏死和充血区域减少,Ki67染色证实肝细胞增殖增强,TUNEL染色显示凋亡细胞减少。基因表达分析表明,3DP-HOs移植显著下调炎症(Il-1b、Tnfa)和纤维化(Col1a1、α-SMA)相关基因,同时上调肝功能(Alb、Cyp2e1)和细胞增殖(Mki67)相关基因。多供体验证显示,不同来源的3DP-HOs均表现出一致的疗效,包括稳定的hALB分泌、肝损伤标志物改善及炎症减轻。3DP-HOs显著改善了Fah−/−小鼠的长期存活率和肝脏病理状态,证实了该疗法在遗传性肝衰竭模型中的有效性和普适性(图5)。
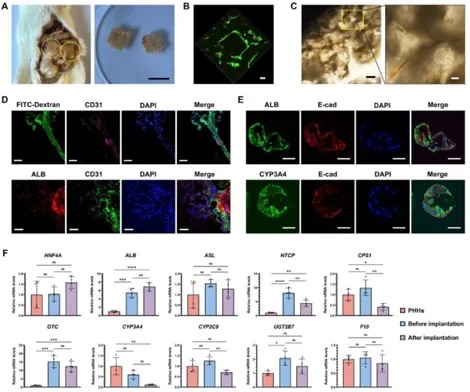
3DP-HOs在Fah−/−肝衰竭小鼠移植60天后,仍保持完整的晶格状结构,GelMA水凝胶无明显降解或解离,表明3DP-HOs在体内可长期存在。活死染色显示移植后细胞存活率高,免疫荧光及CD31染色显示3DP-HOs内形成毛细血管,且血管具备灌注功能,表明3DP-HOs与宿主建立血管连接,保障氧气和营养物质运输。肝细胞标志物ALB、CYP3A4及细胞连接蛋白E-钙粘蛋白持续强表达,表明细胞功能稳定。RT-qPCR分析显示,移植前后3DP-HOs的生物合成、药物代谢及凝血相关基因表达无显著差异,且检测到胆管相关标志物CK7和CFTR,暗示体内微环境促进类器官向胆管方向分化。综上,3DP-HOs在长期移植中展现出卓越的结构稳定性、血管化能力及功能维持性,为肝衰竭治疗的临床转化提供了关键依据(图6)。
