上海市浦东新区蔡伦路780号8层810室
服务案例
朴衡MASH模型助力揭示肝纤维化“关键通路”,GPR91成为潜在治疗新靶点
代谢功能障碍相关的脂肪性肝炎(MASH, metabolic dysfunction-associated steatohepatitis)在全球范围呈现高发态势,全球约有5%的成年人受到MASH的影响,针对MASH的治疗与防范已成为健康领域的重大挑战。MASH是一种复杂的慢性疾病,其主要病理特征为肝细胞脂肪异常积累,并伴有炎症和纤维化的发生。持续的炎症和损伤会刺激肝脏内星状细胞的激活形成纤维化瘢痕组织,纤维化的积累可以导致肝硬化,显著增加肝衰竭和肝癌的风险。抑制纤维化进展将有助于维持肝脏结构的完整性和功能。揭示纤维化进展机制、开发治疗新靶点已成为肝病研究的热点领域。
代谢性疾病研究的一个难题是其发病机制复杂用传统的细胞培养难以模拟,同时实验动物又与人类的代谢差异巨大,需要更加仿生的人源化模型来验证研究机制的可靠性。近日复旦大学吴健教授团队与复旦大学附属中山医院蒋炜教授团队联合在国际权威期刊《Hepatology》(IF=13)在线发表研究论文首次揭示了“琥珀酸-GPR91”信号通路在代谢相关脂肪性肝炎(MASH)肝纤维化中的关键作用机制。在该研究中,研究团队利用朴衡的高仿生人源化3D NAC-Organ MASH模型(朴衡, NN-HS-01)验证了阻断succinate-GPR91轴在人体内可有效抑制肝纤维化进展,明确了GPR91这一G蛋白偶联受体作为抗纤维化治疗靶点的临床转化潜力。该研究为MASH的病理机制研究提供了新视角,也为有效抗纤维化药物开发带来新的研究方向。以下我们为您带来该研究成果的详细解读:

Hepatology,2025 May 19
doi: 10.1097/HEP.0000000000001405.
原文链接:https://pubmed.ncbi.nlm.nih.gov/40392081/
解读
|研究内容
一、琥珀酸加速了MASH模型中肝纤维化的发展
本研究首先利用CDAA-LPS联合诱导建立了稳定的MASH小鼠模型,成功再现了脂肪变性、炎症反应与早期纤维化等病理特征。在此基础上,研究团队通过连续腹腔注射琥珀酸,模拟代谢紊乱状态下琥珀酸的异常积聚,观察其对疾病进展的影响。实验结果显示,琥珀酸的外源性补充显著加重了肝纤维化程度:Masson和Sirius Red染色显示肝脏胶原沉积明显增加,组织学纤维化评分上升,羟脯氨酸含量亦显著升高,提示纤维组织大量生成。在分子层面,琥珀酸处理组肝组织中促纤维化标志物α-SMA、TGF-β1以及其下游信号分子p-Smad3蛋白水平均明显升高,表明肝星状细胞(HSC)被显著激活。同时RT-qPCR检测结果显示,与纤维化密切相关的基因如TIMP1、CTGF和Col-Iα1表达均出现显著上调。证实琥珀酸不仅是MASH代谢失衡过程中的“副产物”,更是一种具备促纤维化效应的“关键信号分子”。其通过增强HSC活化,推动细胞外基质沉积,从而显著加速肝纤维化的进展。
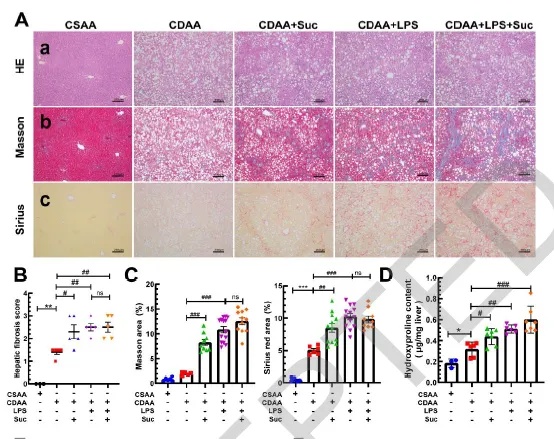
图1 琥珀酸加重MASH小鼠的肝纤维化程度
二、GPR91在MASH纤维化过程中于HSC中高表达,呈病程依赖性上调
进一步探索琥珀酸的作用机制,研究团队聚焦其受体——G蛋白偶联受体91(GPR91)。通过GC-MS检测发现,在CDAA诱导的MASH小鼠中,肝组织内琥珀酸水平显著升高,且其浓度与肝纤维化程度呈正相关关系。为明确GPR91的细胞定位及表达趋势,研究者分离了小鼠原代肝实质细胞、胆管细胞和肝星状细胞(HSC),并对其膜蛋白进行Western blot分析。结果表明GPR91主要高表达于HSC,而在肝细胞和胆管细胞中表达极低。这一表达特异性在两种人源HSC系(LX2和HSC)中亦得到验证。在MASH模型小鼠中,尤其是经琥珀酸注射处理后,GPR91在肝组织中的蛋白水平进一步升高。免疫荧光双染显示,GPR91与活化HSC标志物α-SMA呈明显共定位表达,且信号强度随疾病进展增强,提示其表达与纤维化进程密切相关。GPR91在肝组织中呈HSC特异性表达,并随着MASH纤维化的加重而显著上调。
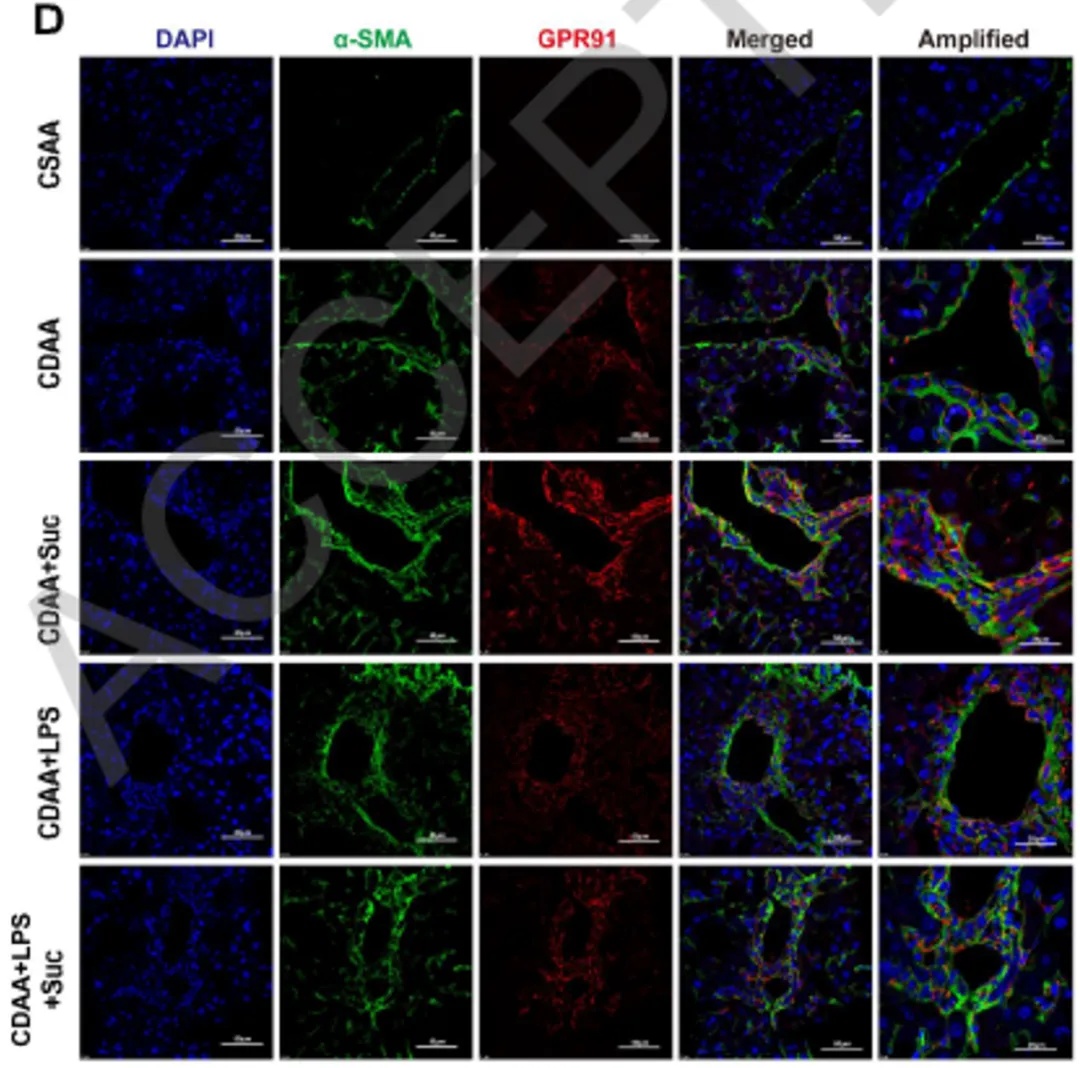
图2 GPR91蛋白在MASH纤维化模型中高表达,并特异性定位于肝星状细胞中
三、GPR91-ERK/c-Jun/Smad3信号轴促进肝星状细胞活化
为了进一步解析GPR91如何介导HSC活化,研究团队搭建了脂肪酸诱导的体外MASH模型,用棕榈酸(PA)与油酸(OA)共同处理原代肝细胞,模拟脂毒性应激状态。实验发现,脂肪酸处理不仅诱导肝细胞内琥珀酸脱氢酶(SDH-A)表达下降,还导致细胞外琥珀酸水平显著上升,提示肝细胞在脂毒损伤下释放琥珀酸。随后研究人员将上述处理产生的富含琥珀酸的上清液用于刺激原代HSC或人源HSC细胞。结果显示GPR91及活化标志物α-SMA表达升高,细胞形态向树枝状扩张,呈典型活化特征。Western blot进一步揭示在GPR91激活后,其下游信号分子ERK1/2、c-Jun及Smad3磷酸化水平显著升高,表明这一通路被成功激活。为了确认c-Jun与Smad3之间的相互作用,研究团队通过共转染Myc-Smad3与Flag-c-Jun并进行免疫共沉淀实验,发现两者在琥珀酸刺激下形成复合体,推动Smad3核转位并启动HSC纤维化程序。qPCR数据显示,GPR91激活后,HSC中TIMP1、Col-Iα1、CTGF等纤维化相关基因的转录水平同步上调。
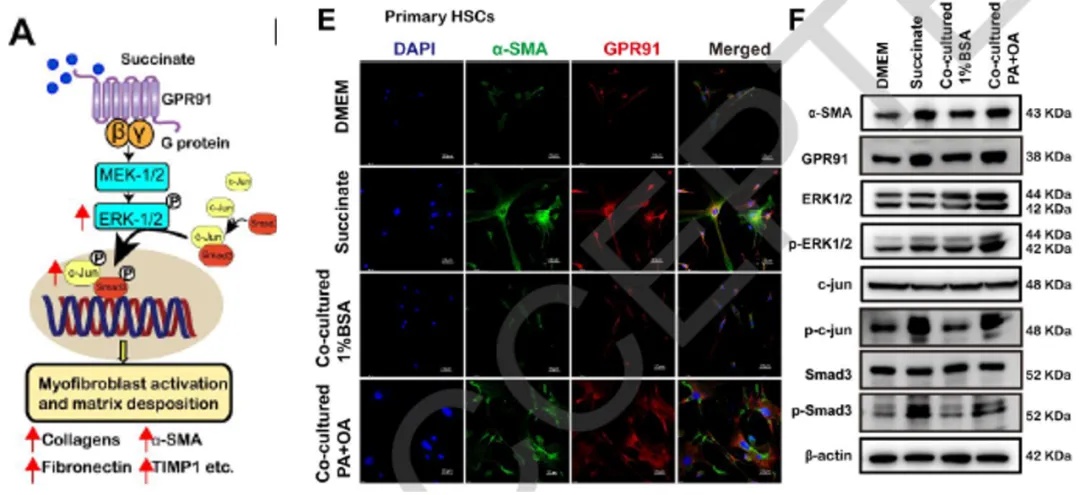
图3 琥珀酸通过GPR91-ERK/c-jun信号通路介导肝星状细胞(HSCs)活化
四、GPR91-Gαi-cAMP-NF-κB信号通路抑制HSC凋亡,维持促纤维化状态
除了激活HSC合成胶原,GPR91还通过抑制细胞凋亡维持其促纤维化表型。研究发现,琥珀酸通过激活GPR91,降低HSC内cAMP水平,进而下调PKA活性,增强NF-κB等转录因子的活性,阻止程序性死亡的发生。实验证实琥珀酸刺激可上调抗凋亡蛋白BCL-2、抑制Caspase-3裂解,显著减少HSC早期凋亡。
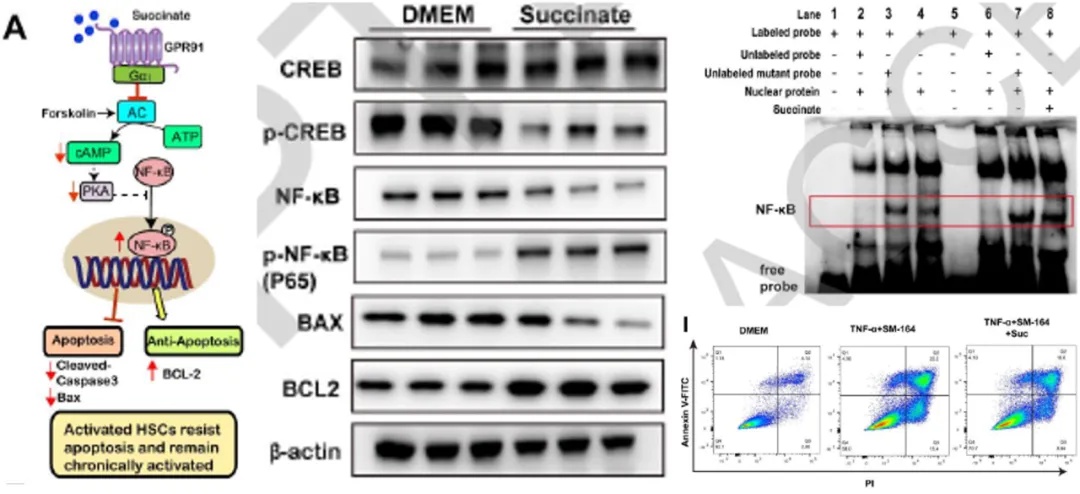
图4 琥珀酸-GPR91-cAMP信号通路调控NF-κB活性并抑制肝星状细胞(HSC)凋亡
五、HSC特异性敲除GPR91显著缓解MASH小鼠肝纤维化
为进一步在体内验证GPR91在MASH相关肝纤维化中的功能,研究团队构建了肝星状细胞特异性GPR91敲除小鼠(HSC-GPR91-KO),并采用高脂高热量饮食+高果糖/葡萄糖饮水(HFCD-HF/G)建立长期MASH模型。结果显示在经历24周高脂饮食诱导后,野生型小鼠表现出典型的肝脂肪变性、炎症、气球样变与显著的纤维化进展,而HSC-GPR91-KO小鼠则呈现出明显减轻的肝组织纤维化表现。Masson与Sirius Red染色结果显示其肝组织胶原沉积区域显著缩小,组织学评分下降。定量检测也证实,羟脯氨酸含量在敲除组中显著低于对照组。值得注意的是,两组小鼠在肝内琥珀酸水平、脂肪变性程度、炎症反应和胰岛素抵抗方面并无显著差异,这进一步说明:GPR91信号通路在MASH中的主要作用是驱动纤维化进展,而非调控代谢本身。为了进一步确认这一结论,研究还分离了两组小鼠的原代HSC,并与PA/OA处理后的原代肝细胞共培养。结果显示,仅野生型HSC在共培养条件下显著上调GPR91及纤维化相关基因表达,而敲除组的HSC则不再响应脂毒信号刺激。
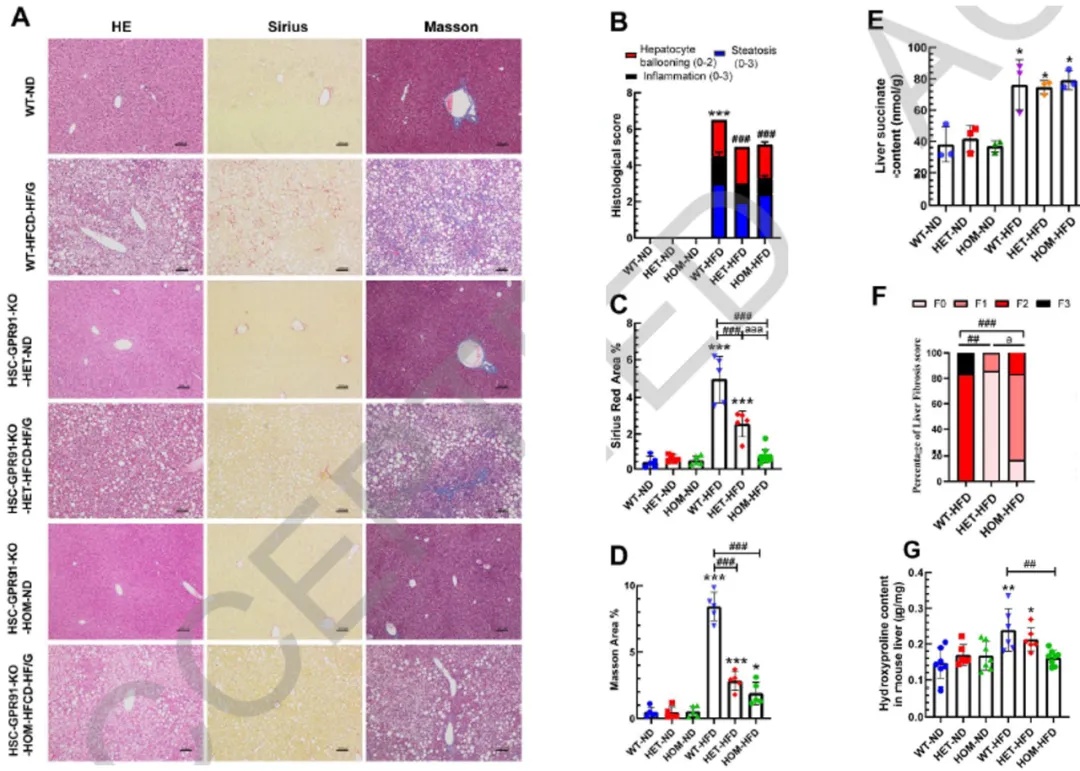
图5 肝星状细胞特异性敲除GPR91可减轻MASH小鼠的肝纤维化
六、HSC特异性敲除GPR91显著缓解MASH小鼠肝纤维化
为进一步验证该机制在人体中的适用性,研究团队采用了人源化3D NAC-Organ MASH模型进行实验。分组给予琥珀酸及GPR91拮抗剂NF-56-EJ40干预。结果显示,琥珀酸处理组类器官中GPR91及纤维化标志物α-SMA显著上调,Sirius红染色提示胶原沉积增加;而GPR91抑制剂干预后,上述指标明显回落,且免疫荧光显示HSC活化被抑制,GPR91表达减弱。这表明在人源化3D模型中succinate-GPR91轴介导的HSC激活及其阻断干预同样发挥了重要作用,证明该调控通路在人体中同样有效,进一步证实了GPR91作为抗纤维化靶点的临床转化潜力。
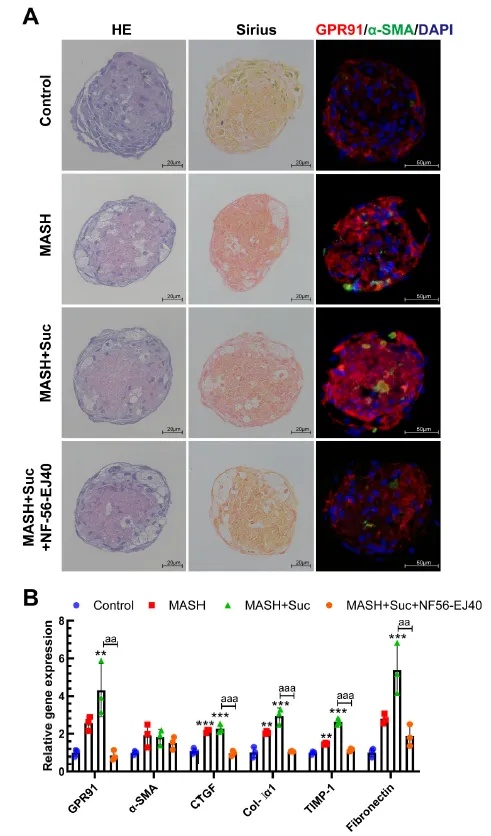
图6 人源化3D NAC-Organ MASH模型验证
结 语
该研究以系统且严谨的体内外实验首次明确了“琥珀酸-GPR91”信号轴在MASH肝纤维化中的双重作用机制——既驱动HSC活化,又抑制其凋亡,构成了纤维化进展的关键分子闭环。通过GPR91的基因敲除与药物拮抗手段,研究团队成功中断了这一通路,并显著逆转肝纤维化病理过程。GPR91在肝组织中的HSC特异性表达特征,使其具备理想的“选择性靶点”潜力。在传统动物实验的基础上,该研究进一步使用高仿生人源化3D NAC-Organ MASH模型验证了“琥珀酸-GPR91”信号轴在人体中作用,为MASH治疗开辟了靶向干预的新路径,有望推动下一代抗纤维化药物的精准开发。
